长期以来,对于5-甲基胞嘧啶(5mC)修饰在真核生物中的调控作用,领域内已有较为全面的认知。近年来,原核生物中广泛存在的DNA修饰——N6-甲基腺嘌呤(6mA),相继被发现存在于高等真核生物基因组中。然而,由于真核生物6mA修饰含量低、形成机制存在争议等因素,致使对6mA修饰的鉴定、分布特征与功能研究等尚处于起步阶段。对于真核生物而言,建立在单碱基分辨率鉴定6mA修饰的新方法,是该领域亟待攻克的难题。
值得注意的是,发现介导6mA修饰的甲基化酶、去甲基化酶,对理解该修饰的分布特征与生物学功能至关重要。尽管已有研究在原核生物中鉴定到若干6mA甲基化酶,如Dam和EcoKI等,但调控真核生物6mA修饰的核心甲基化酶,仍有待揭示。这些不确定性导致目前领域内对于6mA修饰的形成机制、生物学功能等问题存在很大争议,多项研究认为该修饰在真核生物中并非由甲基化酶介导的功能性调控,而是代表DNA复制过程中随机掺入的噪音。因此,在真核生物中,6mA修饰是如何形成的、是否具备特异性的调控功能等,是目前亟待解决的科学问题。
近日,北京大学李川昀团队、刘颖团队合作,报导了能够从单碱基分辨率准确鉴定真核生物DNA 6mA修饰的方法—6mA-Sniper。运用这一方法,他们以模式生物秀丽隐杆线虫( C. elegans )为研究对象,得到了准确的线虫6mA修饰谱,发现METL-9是真核生物核心的6mA甲基转移酶(Cell Research, 2023),明确了6mA修饰是一种受到甲基化酶精确调控的表观遗传调控。同时,揭示了6mA 通过与H3K27me3修饰互作,促进相应基因的转录,进而在铜绿假单胞菌等病原体感染应激中发挥关键作用。题为“6mA-Sniper: Quantifying 6mA Sites in Eukaryotes at Single-Nucleotide Resolution”的工作于2023年10月20日在Science Advances杂志在线发表(https://www.science.org/doi/10.1126/sciadv.adh7912)。
为了实现从单碱基水平鉴定DNA 6mA修饰,需要首先明确6mA修饰与非修饰位点SMRT测序中的动力学信号差异。研究者通过构建质粒和体外甲基化实验得到正对照样品,并通过扩增试剂盒对酿酒酵母基因组样品进行全基因组扩增得到几乎不含6mA修饰的负对照样本。随后,通过分析正、负对照样品中腺嘌呤位点在酶动力学信号脉冲宽度(Pulse Width,PW)和脉冲间隔(Inter-Pulse Duration,IPD)的分布特征,发现正对照中腺嘌呤的IPD信号值整体呈现显著偏大的分布,提示IPD信号在6mA修饰与非修饰位点间的差异可用于从单碱基分辨率水平鉴定6mA位点。为了提升IPD信号的信噪比,研究者利用待测腺嘌呤上游邻近非腺嘌呤的IPD信号,对待测序位点的IPD值进行了矫正,降低了多次读取间的信号差异,显著提升了信噪比,并在此基础上开发了可从单碱基分辨率鉴定6mA修饰的新方法6mA-Sniper。
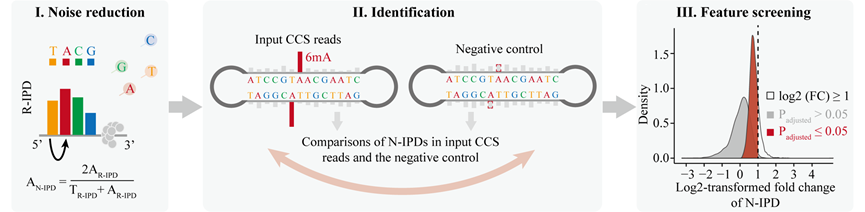
6mA-Sniper:从单碱基分辨率鉴定6mA修饰的方法开发流程图
为了验证 6mA-Sniper 鉴定的可靠性,研究者对线虫全基因组6mA位点进行了鉴定,得到了线虫6mA修饰谱,包含2,034个6mA修饰位点,富集在[G/C]GAG序列模体。进一步,研究者利用限制性内切酶策略(识别序列 GAGG的MnlI 内切酶)对39个随机选取的位点进行了验证,发现其中 26 个位点能够被成功验证。考虑到限制性内切酶策略敏感性较低,因此6mA-Sniper的鉴定准确率应高于上述验证比例。值得一提的是,研究团队近期在Cell Research刊文报道METL-9是线虫6mA修饰的核心甲基转移酶,且在病原体感染时显著上调(https://doi.org/10.1038/s41422-023-00826-y)。通过对这些样本进行SMRT测序,并运用6mA-Sniper对相应的6mA修饰谱进行鉴定,研究者发现敲除METL-9后,上述鉴定得到的线虫6mA位点的修饰水平显著下降,而病原体感染后,6mA位点的修饰频率整体上调。这些证据表明,6mA-Sniper可以对真核生物6mA位点进行准确鉴定,而在真核生物中,6mA修饰同样是一种受到甲基化酶精确调控的表观遗传调控,而并非代表DNA复制过程中随机掺入的噪音。
为了从分子水平进一步阐明6mA修饰的调控作用,研究者首先细致研究了6mA位点的染色体定位特征,发现这些位点显著富集在基因组的功能区,如外显子、启动子、核小体占位等区域,尤其是与H3K27me3修饰呈现共定位。通过CRISPR/Cas9基因组编辑实验,研究者发现这些6mA位点可以通过抑制H3K27me3修饰,直接激活所在基因的表达会导致相应基因的表达,而这些基因的激活,在线虫应对铜绿假单胞菌等病原体感染应激中发挥了关键作用。值得一提的是,通过群体遗传学研究,研究者发现 6mA 位点在群体内收到自然选择约束,提示由6mA修饰介导的转录激活,可能作为一种重要的表观遗传标记,在真核生物应激反应中发挥功能。
李川昀课题组长期运用恒河猴作为人类近缘模式动物的优势,开展生物信息学与分子医学研究,产生了多层次、多模态的非人灵长类组学数据,并开发了80多套生物信息学新算法和分析工具,对自产和公共的高通量数据进行了深度整合与挖掘,将恒河猴升级为可支撑高精度功能与机制研究的特色模型(Nucleic Acids Research, 2013, 2023; Briefings in Bioinformatics, 2021; Nature Communications, 2018; Molecular Biology and Evolution, 2014, 2016),并以此为基础,开展了一系列以恒河猴为特色的人类演化与复杂疾病分子机制研究,为解析“人之为人”的分子基础提供了新理论和重要例证,并为复杂疾病机制研究与药靶发现提供了新思路(Nature Ecology Evolution, 2023; Science Advances, 2023; Advanced Science, 2023; Cell Research, 2023; Genome Biology, 2021; Nature Communications, 2020; Circulation Research, 2019; PNAS, 2018; Molecular Biology and Evolution, 2015, 2017; PLOS Genetics, 2012, 2014, 2015),相关系列工作为本项研究的顺利完成提供了支撑。李川昀课题组长期招收硕博连读研究生、直博生,并欢迎具有生物学、信息科学等交叉学科背景的优秀博士毕业生,依托北京大学“博雅计划”等开展博士后研究工作。
北京大学未来技术学院分子医学研究所张杰博士(已毕业)、彭琪博士(已毕业)、马成川博士(博士后出站)、博士生王佳欣同学为本文的共同第一作者。北京大学未来技术学院李川昀教授、刘颖教授担任本文通讯作者。本研究受到北京大学未来技术学院、北京大学蛋白质与植物基因研究国家重点实验室、西南联合研究生院等平台与单位支撑,同时受到国家重点研发计划、国家自然科学基金委、北京脑科学与类脑研究中心的经费支持。
