ATP敏感的钾离子通道(ATP-sensitive potassium channel, KATP)是由内向整流型Kir6(Inward-rectifier potassium channel)通道亚基和发挥调节作用的SUR(Sulfonylurea receptor)亚基组成的异源八聚体。KATP通道可以被ATP抑制、被Mg-ADP激活,通过感受细胞内ATP/ADP浓度比例的变化,改变自身通道活性,从而将细胞内的代谢信号转化为细胞膜电势的变化1。胰岛β细胞中的KATP通道由Kir6.2亚基和SUR1亚基组成,通过直接感受细胞内ATP/ADP的浓度比例,间接感受血糖浓度,从而调控胰岛素的释放。靶向胰岛KATP通道的胰岛素促泌剂在临床上广泛应用于糖尿病的治疗;而其激活剂如二氮嗪用于治疗低血糖2。
KATP通道上既含有抑制性核苷酸结合位点也含有激活性核苷酸结合位点。ATP通过结合在Kir6亚基上的抑制性核苷酸结合位点抑制KATP通道3。Mg-ATP和Mg-ADP通过与SUR亚基核苷酸结合域NBD(Nucleotide-binding domain)结合,促进NBD二聚以及SUR的构象变化来激活Kir6通道4。探究细胞内核苷酸对KATP通道抑制和激活作用的原理是理解KATP生理功能的关键。
2022年5月19日,北京大学未来技术学院分子医学研究所、生命科学联合中心、国家生物医学成像中心陈雷研究组在Nature Communications杂志发表了题为 “Structural insights into the mechanism of pancreatic KATP channel regulation by nucleotides” 的论文。链接见:https://www.nature.com/articles/s41467-022-30430-4
KATP的开放需要PI(4,5)P2,但野生型KATP对PI(4,5)P2的亲和力低,不适合用于纯化蛋白的结构生物学研究。为了获得KATP通道在激活状态的结构,陈雷课题组首先通过筛选发现Kir6 的H175K突变体能够显著增强PI(4,5)P2亲和力。进一步地,通过向H175K突变体蛋白中添加Mg-ADP和激活剂NN414的方法制备冷冻电镜样品,并使用单颗粒冷冻电镜技术,在同一个样品中获得了关闭状态和预开放状态的两种构象的结构。
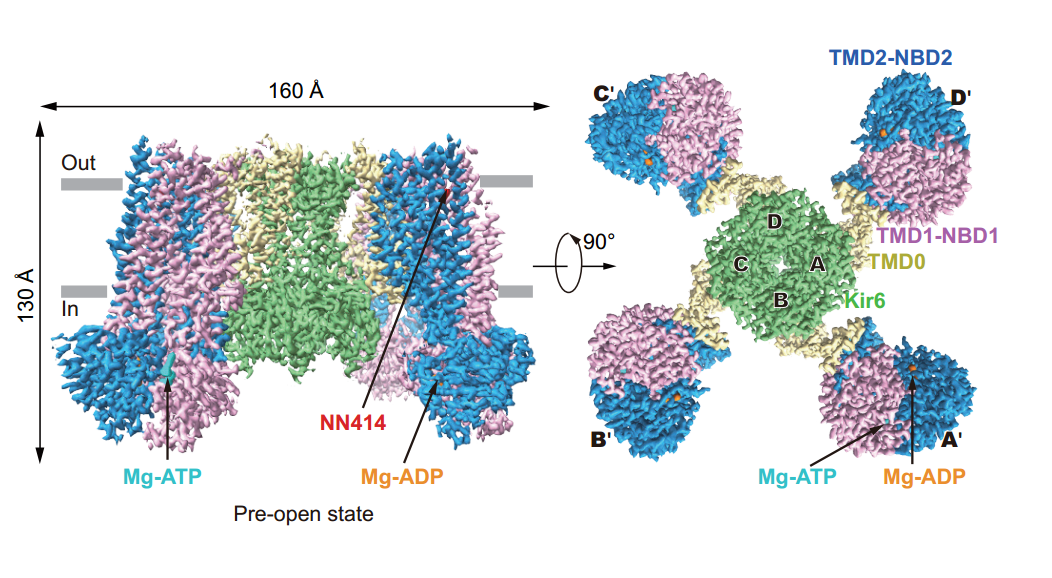
图1:胰岛KATP通道H175Kcryo-EM预开放状态结构的侧视图和从胞内侧看的底部视图。Kir6.2、SUR1 TMD0-ICL3片段、TMD1-NBD1和TMD2-NBD2分别以绿色、黄色、紫色和蓝色显示。Mg-ADP、Mg-ATP和NN414分别显示为橙色、青色和红色。
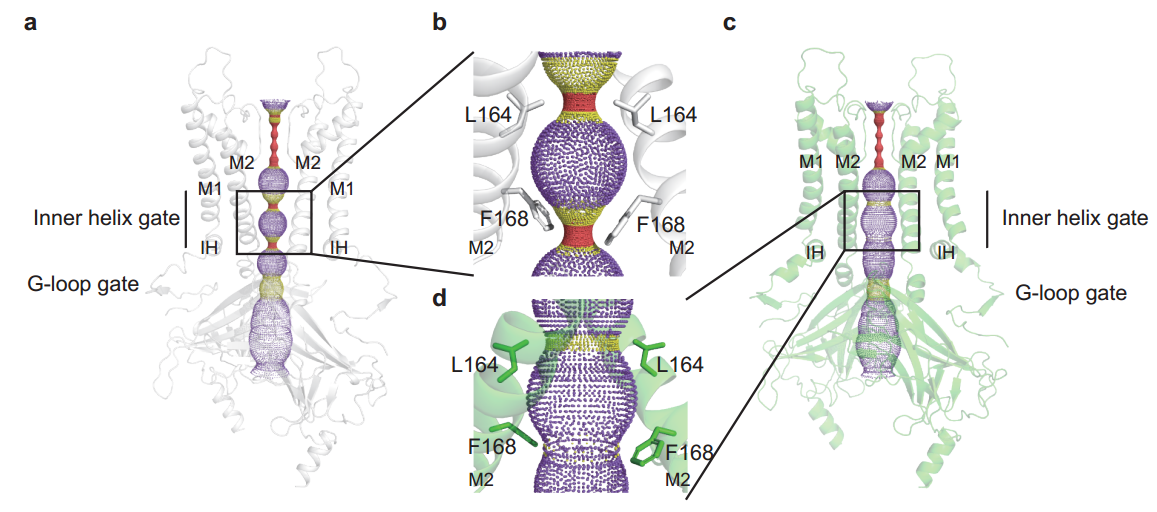
图2:Kir6.2跨膜结构域在KATP通道开放过程中的构象变化。(a)H175Kcryo-EM的Kir6.2亚基在关闭状态的侧视图。(b)突出展示图(a)中门控氨基酸L164和F168残基。(c)H175Kcryo-EM的Kir6.2亚基在预开放状态的侧视图。(d)图(c)中M2螺旋放大展示。
电子密度显示,关闭状态结构的抑制性核苷酸结合位点结合有核苷酸,而预开放状态结构的抑制性核苷酸结合位点没有配体结合。结构比对表明:Mg-ADP和NN414的结合导致SUR1亚基上核苷酸结合结构域NBD1和NBD2形成非对称的二聚体,引起跨膜结构域TMD1和TMD2关闭,带动L0向外移动。通道在开放过程中,TMD0发生向外旋转的构象变化,抑制性核苷酸从Kir6.2亚基上解离,Kir6.2亚基胞内结构域发生扭转,从而带动Kir6.2通道的门打开。
该研究为深入理解核苷酸在通道开放过程中的调控机制提供了结构基础。此外,该研究还清晰地观测到了SUR1特异性通道激活剂NN414的结合模式。
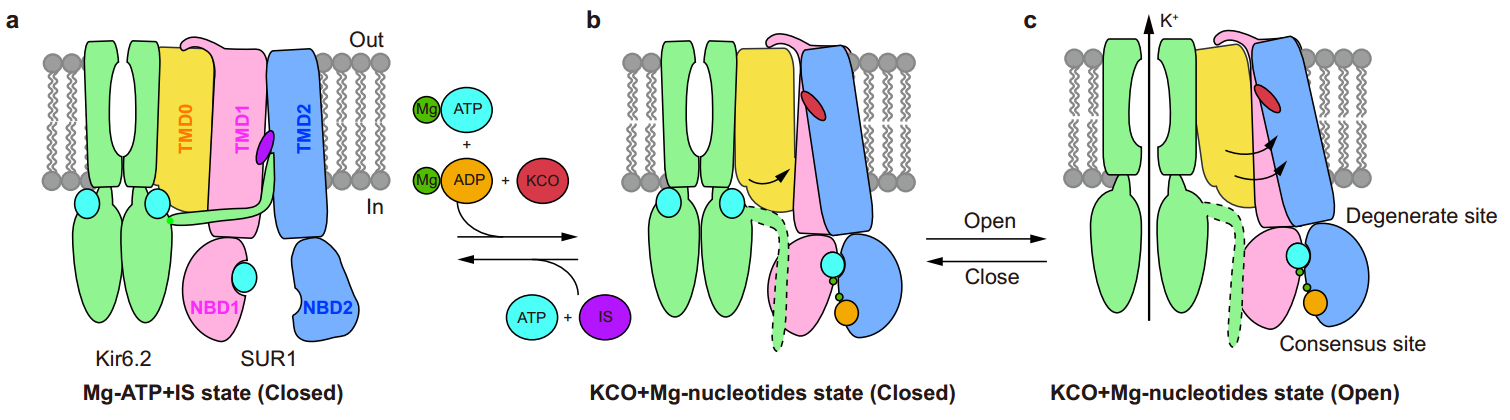
图3:Mg-核苷酸和道激活剂激活KATP通道的工作机制模型。(a)-(c)以KATP通道的侧视图展示通道被Mg-核苷酸和道激活剂激活的过程。Kir6、TMD0、TMD1-NBD1、TMD2-NBD2、镁离子、ATP、ADP、胰岛素促泌剂(IS)和KATP开放剂(KCO)的颜色分别为绿色、黄色、粉色、蓝色、深绿色、青色、橙色、紫色和红色。箭头表示TMD0和整个SUR1亚基的构象变化。
该项研究在2021年11月29日即公布在预印本BioRxiv上(https://www.biorxiv.org/content/10.1101/2021.11.29.470334v1)。2021年11月美国洛克菲勒大学Roderick MacKinnon研究组在PNAS杂志上也报道了人源KATP通道在预开放状态的结构5。结构比对显示,这两个预开放结构基本一致。
该项研究的第一作者为北京大学前沿交叉学科研究院CLS项目博士研究生王萌萌,陈雷研究员为通讯作者,博士后吴惊香和博士研究生丁典也参与了该工作。本工作获得国家自然科学基金委、生命科学联合中心以及北京大学李革-赵宁生命科学青年研究基金的经费支持。该工作中冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台和北京大学电镜室完成,得到了李雪梅、郭振玺、秦昌东、邵博、裴霞和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。
参考文献:
1 Nichols, C. G. KATP channels as molecular sensors of cellular metabolism. Nature 440, 470-476, doi:10.1038/nature04711 (2006).
2 Jahangir, A. & Terzic, A. KATP channel therapeutics at the bedside. J. Mol. Cell. Cardiol. 39, 99-112, doi:10.1016/j.yjmcc.2005.04.006 (2005).
3 Enkvetchakul, D. & Nichols, C. G. Gating mechanism of KATP channels: function fits form. J. Gen. Physiol. 122, 471-480, doi:10.1085/jgp.200308878 (2003).
4 Proks, P., de Wet, H. & Ashcroft, F. M. Activation of the KATP channel by Mg-nucleotide interaction with SUR1. J. Gen. Physiol. 136, 389-405, doi:10.1085/jgp.201010475 (2010).
5 Zhao, C. & MacKinnon, R. Molecular structure of an open human KATP channel. Proc. Natl. Acad. Sci. U. S. A. 118, doi:10.1073/pnas.2112267118 (2021).
