最近,未来技术学院生物医学工程系陈匡时课题组基于RNA纳米技术发展了一种可干扰HIV-1病毒在细胞膜上组装的RNA纳米材料。该研究成果已发表于学术期刊 Nucleic Acids Research (IF = 16.971) ,题目为“Rational design of self-assembled RNA nanostructures for HIV-1 virus assembly blockade”。文章链接:https://doi.org/10.1093/nar/gkab1282
HIV-1病毒的重要结构蛋白Gag蛋白是一种RNA结合蛋白,可与病毒的基因组RNA(genome RNA, gRNA)发生相互作用,并以其作为支架,在细胞膜上进行多聚化,最终组装形成病毒颗粒。迄今为止,有大量研究结果证明,除病毒RNA之外,Gag蛋白也能与多种宿主细胞RNA形成RNA-蛋白质复合体,其中,陈匡时课题组在早期研究中发现宿主细胞中的小RNA(microRNA)能够与Gag蛋白发生相互作用,并可与细胞膜上的病毒RNA-Gag蛋白相互作用产生竞争,进而干扰病毒RNA介导的Gag蛋白多聚化,导致病毒颗粒组装失败( Proc Natl Acad Sci U S A . 2014 Jul 1; 111(26): E2676–E2683; Protein Cell . 2018; 9(7): 640–651),这提示小RNA具有治疗HIV-1感染的潜力。
相比于天然小RNA,人工合成的RNA寡核苷酸具有在碱基构成、分子大小、结构和化学修饰等方面可调整性、可控制性高的优势,并且可以通过RNA纳米技术组装形成更加复杂的纳米结构,是一种可修饰性高、稳定性好、生物安全性高的纳米材料。本工作在前期天然小RNA研究的基础上,以人工合成的2’- O -Methyl修饰的RNA寡核苷酸为原料,通过自组装的技术开发了一种模块化的RNA纳米材料,能够在细胞中高效抑制HIV-1病毒组装。
在本研究中,课题组首先发现相较于无特定结构的RNA寡合苷酸,Gag蛋白在细胞膜上对可形成发夹结构的寡核苷酸具有更高的结合倾向性,并且该结合倾向性是不依赖于特定碱基序列的(sequence-independent)。 Gag与发夹结构RNA的相互作用可以显著抑制HIV-1病毒颗粒产生(图1)。随后,课题组将此概念引入设计可自组装的RNA原件,将具有发夹结构RNA寡核苷酸作为基本组装模块,得到具有多个发夹结构的RNA自组装纳米材料。相比于单个基本组装模块,该纳米结构对HIV-1病毒颗粒产生的抑制效果有显著的提升(图2)。最后,通过单分子荧光原位杂交(FISH)技术同时对病毒RNA和RNA纳米材料进行成像、单分子定位显微技术对Gag蛋白在细胞膜上的组装平台进行超分辨率成像并进行蛋白聚落分析,课题组提出了纳米材料在细胞膜上抑制HIV-1病毒组装的模型(图2)。本工作拓展了RNA自组装纳米材料在生物医学领域的应用,有望为HIV-1 病毒和其它复制过程依赖于RNA-蛋白互作的RNA病毒(如新冠病毒SARS-COV-2等)所引发的相关疾病提供新的治疗思路。
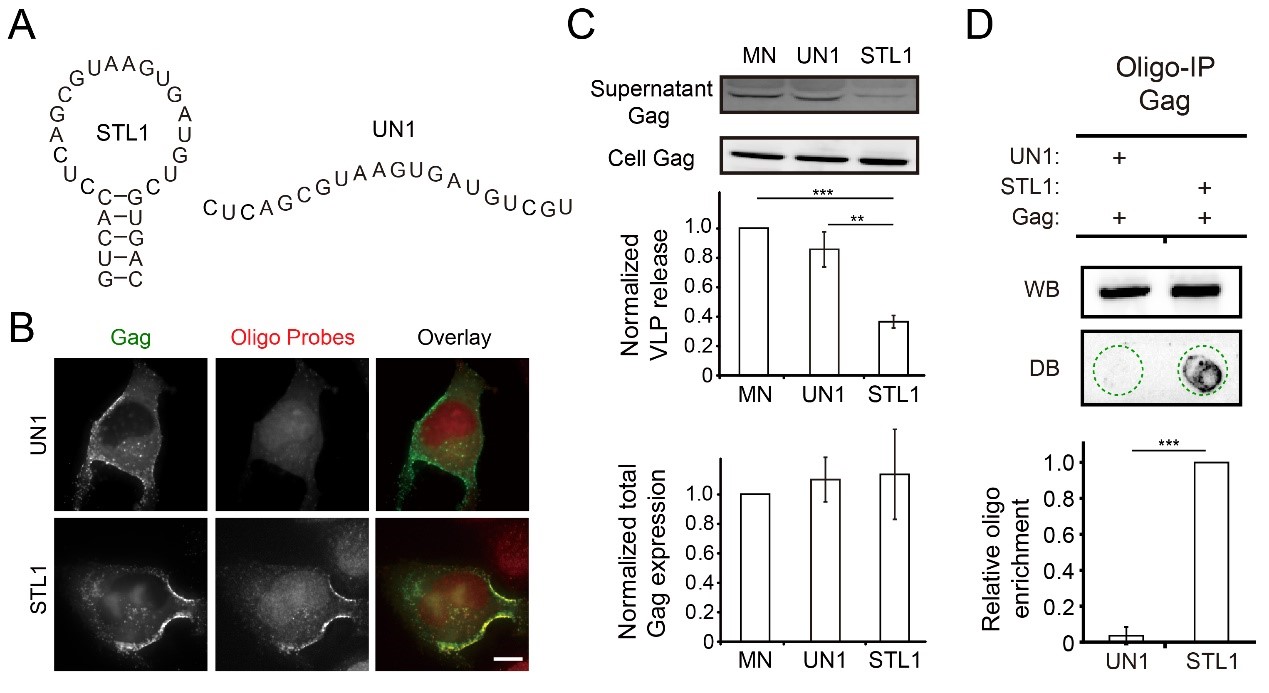
图1. 发夹结构的RNA寡核苷酸(STL1)比无特定结构的寡合苷酸(UN1)在细胞膜上与Gag蛋白有更强的互作,进而有效抑制HIV-1病毒颗粒产生
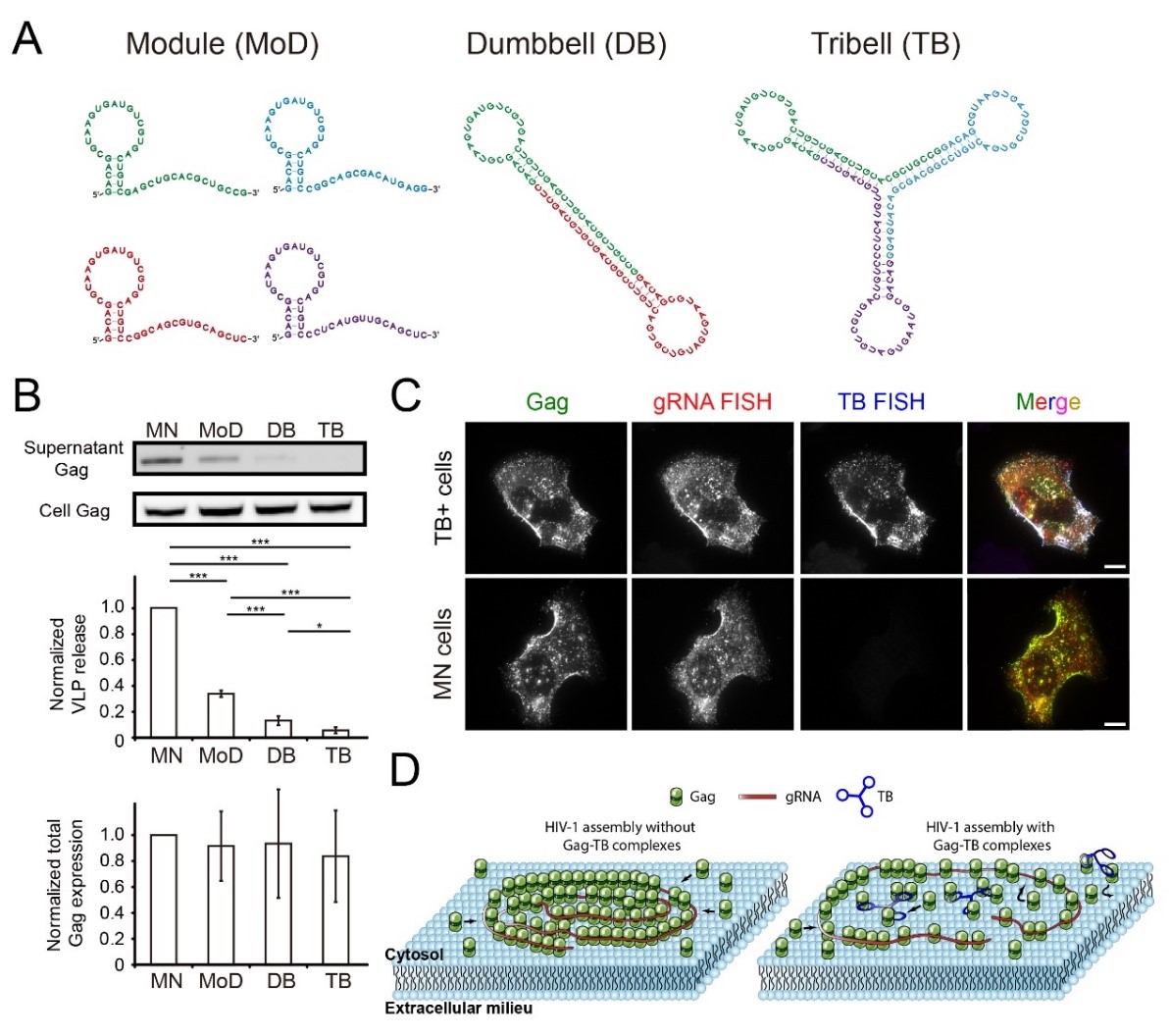
图2. 将多个带有发夹结构的寡合苷酸通过自组装构建得到对HIV-1组装干扰性更强的纳米结构
未来技术学院陈匡时课题组已毕业博士生曲娜是本工作的第一作者,课题组博士生应亚宸以及博士后秦金珊为工作的顺利完成做出重要贡献,陈匡时研究员为本工作的通讯作者。本工作得到了国家重点研发计划和国家自然科学基金的支持。
