线粒体是细胞进行有氧呼吸的主要场所,也是细胞代谢的“能量工厂”。线粒体内膜上的电子传递链在将电子从还原性辅酶转移到氧气上时会同时泵出质子,使线粒体内膜两侧存在质子浓度差,从而推动ATP合酶的转动来生成ATP1。在此过程中,线粒体内膜对于质子的低通透性确保了电子传递过程与ATP生成之间的紧密偶联。棕色脂肪组织是哺乳动物中重要的产热器官,其高表达位于线粒体内膜上的解偶联蛋白1(UCP1)。当受到寒冷刺激时,UCP1被激活并转运质子,使电子传递过程与ATP生成解偶联,从而将质子梯度转化为热能释放2,3。越来越多的证据表明激活棕色脂肪产热能够有效对抗肥胖及相关代谢疾病4,5,并在肿瘤治疗中具有临床应用前景6。
UCP1是产热过程的最终效应分子,其活性受到严格调控。通常情况下UCP1的活性被胞质侧高浓度的嘌呤核苷酸抑制(生理条件下主要是ATP)。当受到寒冷刺激时,交感神经释放去甲肾上腺素,作用于棕色脂肪细胞,促进脂肪水解,产生的脂肪酸能够克服ATP的抑制作用并激活UCP1来产热2,3。此外,一些人工合成的化学小分子解偶联剂,包括2,4-二硝基苯酚(DNP)也能够有效的激活UCP17。但目前仍不清楚DNP和ATP是如何与UCP1结合并调控其活性的。
2023年6月19日,北京大学未来技术学院分子医学研究所陈雷课题组,在Nature杂志发表题目为Structural basis for the binding of DNP and purine nucleotides onto UCP1的文章,报道了人源UCP1处于无核苷酸结合、DNP结合以及ATP结合三种状态的高分辨率冷冻电镜结构,链接为https://www.nature.com/articles/s41586-023-06332-w。
UCP1是分子量仅为~32 kDa且没有明显可溶结构域的膜蛋白。使用冷冻电镜技术直接对其结构进行解析具有较大难度。因此作者们筛选了人工合成的纳米抗体(sybody)库8,9,得到了识别UCP1的sybody,并使用legobody10策略进一步增大分子量。作者们在克服了蛋白纯化、纳米盘重组、冷冻样品制备和数据处理等一系列困难之后,最终获得了UCP1处于无核苷酸结合、DNP结合以及ATP结合三种状态的分辨率为2.51 Å-2.57 Å的电子密度,并搭建了原子模型。
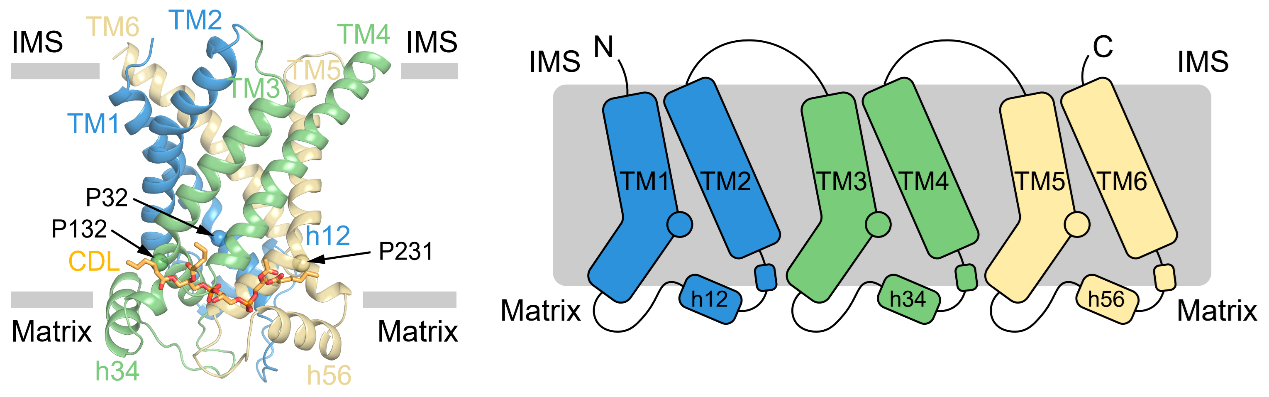
图1:UCP1的结构和拓扑示意图
UCP1属于线粒体载体家族,为6次跨膜的转运蛋白,由三个折叠类似的重复组成。每个重复由两根跨膜螺旋和基质侧的短螺旋组成,其中奇数次跨膜螺旋含有保守的脯氨酸并发生了明显的弯折(图1)。此外,作者们还观察到了心磷脂(CDL)与UCP1存在紧密结合(图1)。作者们发现处于无核苷酸结合状态的UCP1处于胞质侧开放的构象(c-state),且中央空腔具有较多正电(图2),有利于与胞质侧带有负电的嘌呤核苷酸结合。
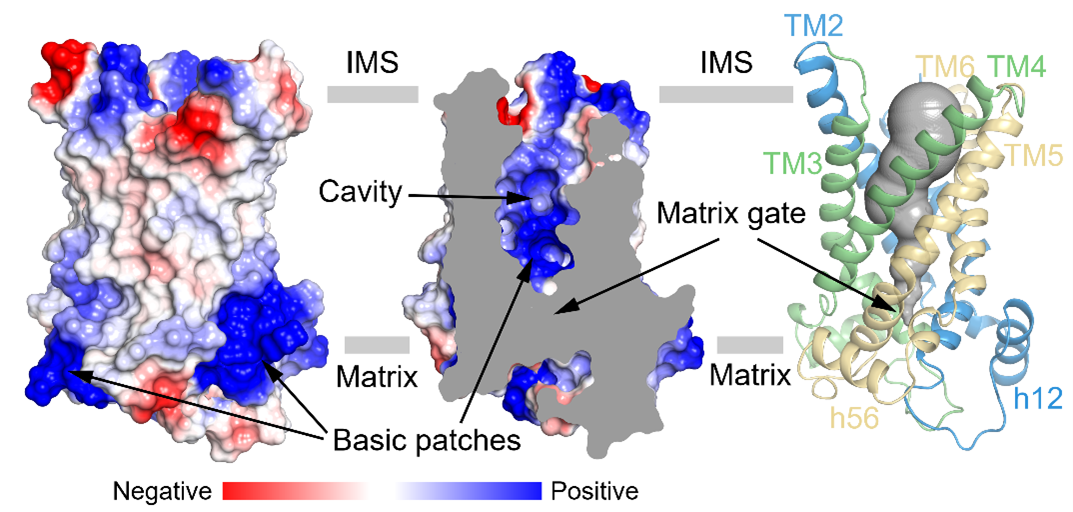
图2:UCP1处于胞质侧开放的构象
DNP结合状态的UCP1也处于c-state,整体结构与无核苷酸结合状态的UCP1类似。DNP通过π-π以及亲水和静电相互作用结合在UCP1中央空腔的TM2和TM6之间,并引起了R91和R276的构象改变(图3)。
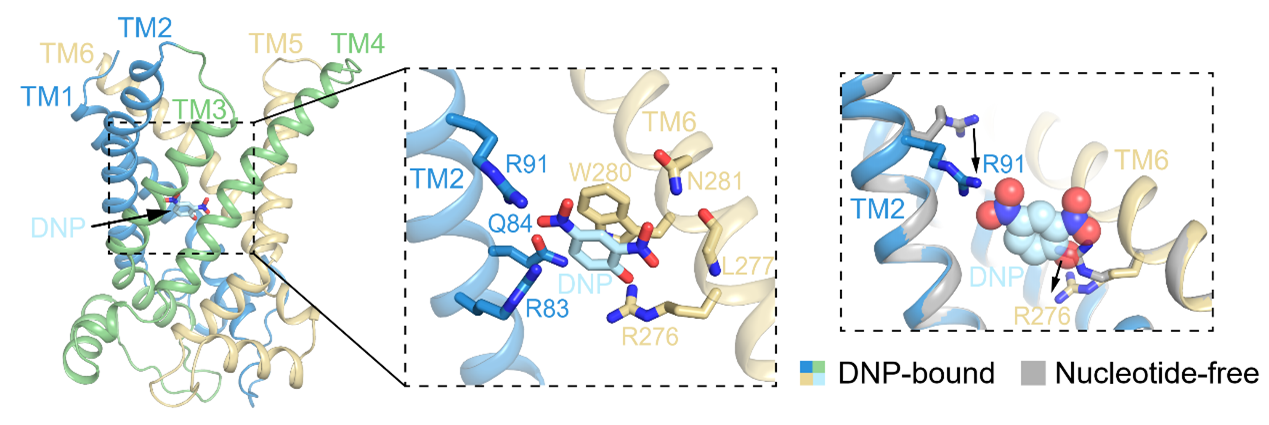
图3:DNP的结合位点
ATP与UCP1的结合位点与DNP的结合位点相似,也位于UCP1的中央空腔内,与多个TM发生紧密的相互作用。ATP的腺嘌呤与TM2的R91发生cation-π相互作用,从而使TM2向内弯折,并推动TM1、TM4、TM5和TM6也发生构象变化,使UCP1转变为胞质侧开口变小,结构更加紧凑的构象(图4)。除了R91,ATP的结合还会引起R83和R276的构象变化(图4)。此外,ATP与DNP的结合位点在空间上直接冲突,这解释了为何ATP能抑制DNP激活UCP1。
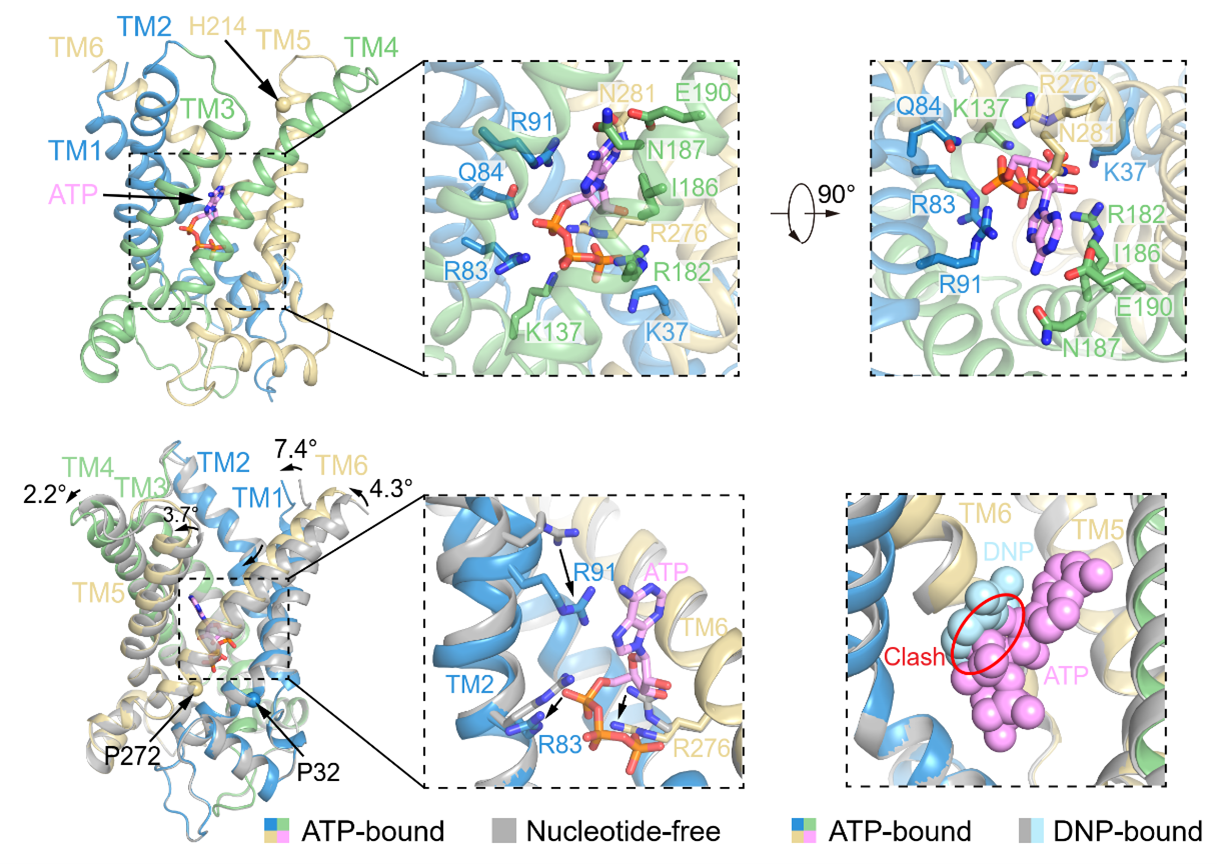
图4:ATP的结合位点
综上所述,作者们通过冷冻电镜对不同状态下的UCP1的结构进行解析,从原子水平上观察到了DNP和ATP是如何与UCP1结合并引起构象变化的,为深入理解UCP1的工作机制提供了结构基础。
本项研究第一作者为陈雷课题组博士后康云路,陈雷研究员为第二作者兼通讯作者。北京大学未来技术学院分子医学研究所邱义福研究员和薛凯丽博士对于该课题的实施提供了宝贵建议。苏黎世大学的Markus Seeger教授提供了sybody的mRNA文库。上海生化与细胞所李典范教授和李婷婷博士对于sybody的筛选提供了建议。本工作获得科技部重点研发计划、国家自然科学基金委、生命科学联合中心经费支持。博士后康云路获得了北京大学博雅博士后奖学金的支持。该工作冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台和北京大学电镜室完成,得到了李雪梅、郭振玺、裴霞、秦昌东、惠小娟和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。
参考文献:
1 Schultz, B. E. & Chan, S. I. Structures and proton-pumping strategies of mitochondrial respiratory enzymes. Annu Rev Biophys Biomol Struct 30, 23-65, doi:10.1146/annurev.biophys.30.1.23 (2001).
2 Divakaruni, A. S. & Brand, M. D. The regulation and physiology of mitochondrial proton leak. Physiology (Bethesda) 26, 192-205, doi:10.1152/physiol.00046.2010 (2011).
3 Chouchani, E. T., Kazak, L. & Spiegelman, B. M. New Advances in Adaptive Thermogenesis: UCP1 and Beyond. Cell Metab 29, 27-37, doi:10.1016/j.cmet.2018.11.002 (2019).
4 Becher, T. et al. Brown adipose tissue is associated with cardiometabolic health. Nature medicine 27, 58-65, doi:10.1038/s41591-020-1126-7 (2021).
5 Cypess, A. M. Reassessing Human Adipose Tissue. The New England journal of medicine 386, 768-779, doi:10.1056/NEJMra2032804 (2022).
6 Seki, T. et al. Brown-fat-mediated tumour suppression by cold-altered global metabolism. Nature 608, 421-428, doi:10.1038/s41586-022-05030-3 (2022).
7 Bertholet, A. M. et al. Mitochondrial uncouplers induce proton leak by activating AAC and UCP1. Nature 606, 180-187, doi:10.1038/s41586-022-04747-5 (2022).
8 Zimmermann, I. et al. Synthetic single domain antibodies for the conformational trapping of membrane proteins. Elife 7, doi:10.7554/eLife.34317 (2018).
9 Zimmermann, I. et al. Generation of synthetic nanobodies against delicate proteins. Nat Protoc 15, 1707-1741, doi:10.1038/s41596-020-0304-x (2020).
10 Wu, X. & Rapoport, T. A. Cryo-EM structure determination of small proteins by nanobody-binding scaffolds (Legobodies). Proceedings of the National Academy of Sciences of the United States of America 118, doi:10.1073/pnas.2115001118 (2021).
