细胞是生命活动的基本单位,其内部包含众多细胞器,这些细胞器相互协作,共同维持细胞的正常功能。然而,由于细胞器的尺寸微小、动态变化迅速且种类繁多,对活细胞内细胞器的实时成像一直是科学界面临的难题。荧光染色是研究细胞器的重要工具,并多次获得诺贝尔奖。然而,传统的特异性荧光标记技术虽然能够对3-4种细胞器进行成像,但随着标记数目的增加,就容易出现光谱串扰和标记不上的问题,严重阻碍了多细胞器互作的研究进程。
近日,一项发表于《自然·通讯》杂志的研究成果,为活细胞内多细胞器的成像难题带来了重大突破。来自北京大学未来技术学院席鹏团队联合东方理工大学金大勇团队利用脂膜探针标记所有的有膜细胞器,再结合转盘共聚焦显微镜和深度学习成功实现了15种细胞结构的同时成像。该方法打破了传统多色成像的通道数量上限,为测绘活细胞内多种亚细胞器互作图谱提供有力工具。这一工作以“Fast Segmentation and Multiplexing Imaging of Organelles in Live Cells”为题发表在Nature Communaications上。

为了解决荧光特异性标记的难题,研究人员采用了“反其道而行之”的策略,即放弃多细胞器标记的特异性,转而利用一种名为尼罗红的脂质染料对多种细胞器的膜结构进行非特异性染色。而在进入不同的有膜细胞器后,染料特有的“环境变色”能力使其能够揭示所在的细胞器中类。由于尼罗河红的发射光谱对膜的组分与环境非常敏感,通过双波段同时双色成像,可以通过光谱信息区分形状和大小相似的细胞器。结合转盘共聚焦超分辨显微的高速、低光毒性成像能力,研究人员能够在短时间内获取大量高时空分辨率的图像数据。
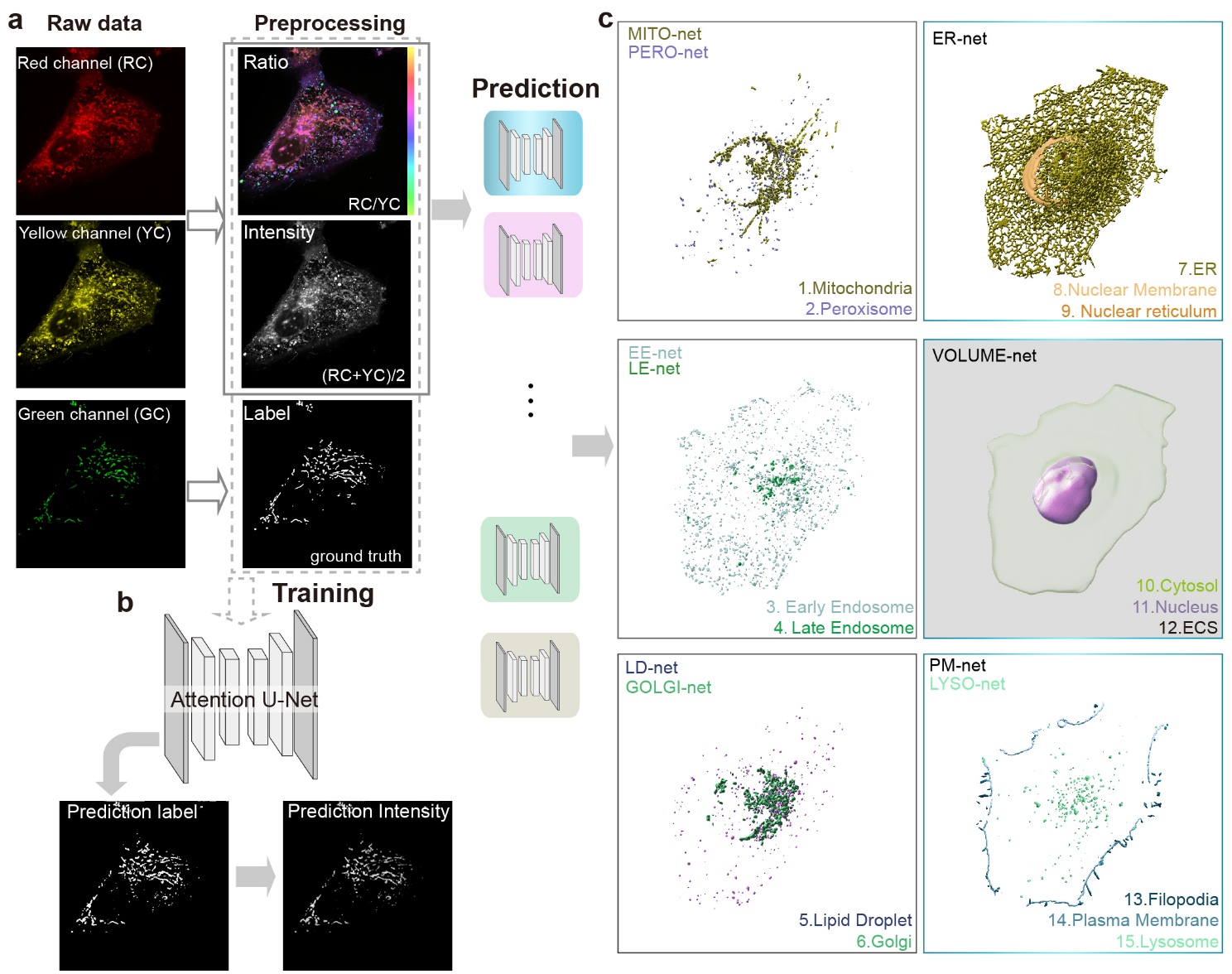
图1通过尼罗河红脂质染料标记、超高分辨率成像与深度学习算法的深度融合实现细胞内15种细胞器结构的精准解析:线粒体,内质网,脂质液滴,细胞膜,溶酶体,内吞体,高尔基体,核膜,过氧化酶体,细胞伪足,核内陷体,细胞核,细胞质和细胞外基质。
在此基础上,研究人员引入了深度学习技术,训练了一组深度卷积神经网络,能够从尼罗河红染色的图像中学习并预测出15种细胞器的精确位置和形态(图1)。与传统的图像分割方法相比,基于深度学习的方法不仅速度快、准确度高,而且具有很强的稳定性和可重复性。通过对大量图像数据的训练,DCNN网络能够自动识别细胞器的特征,从而实现对细胞器的快速分割和多路复用成像。
这一技术对于传统的特异性荧光标记、多色成像带来了革命性的突破,使得仅使用1种或少数几种染料即可实现多细胞器的实时成像与互作。同时,由于尼罗河红染料的高效性和深度学习算法的高精度,该技术能够在减少光毒性的同时,实现对细胞器动态变化的长时间观察。这对于研究细胞器在细胞周期中的变化(图2)、细胞器之间的相互作用以及细胞在不同生理和病理状态下的行为具有重要意义。
此外,该技术还展示了良好的普适性和扩展性。研究人员在多种细胞系和组织样本中验证了该技术的有效性,并成功将其应用于果蝇睾丸组织的成像中,实现了对活体组织内细胞器的多路复用成像。这为未来在更复杂的生物样本中应用该技术奠定了基础。
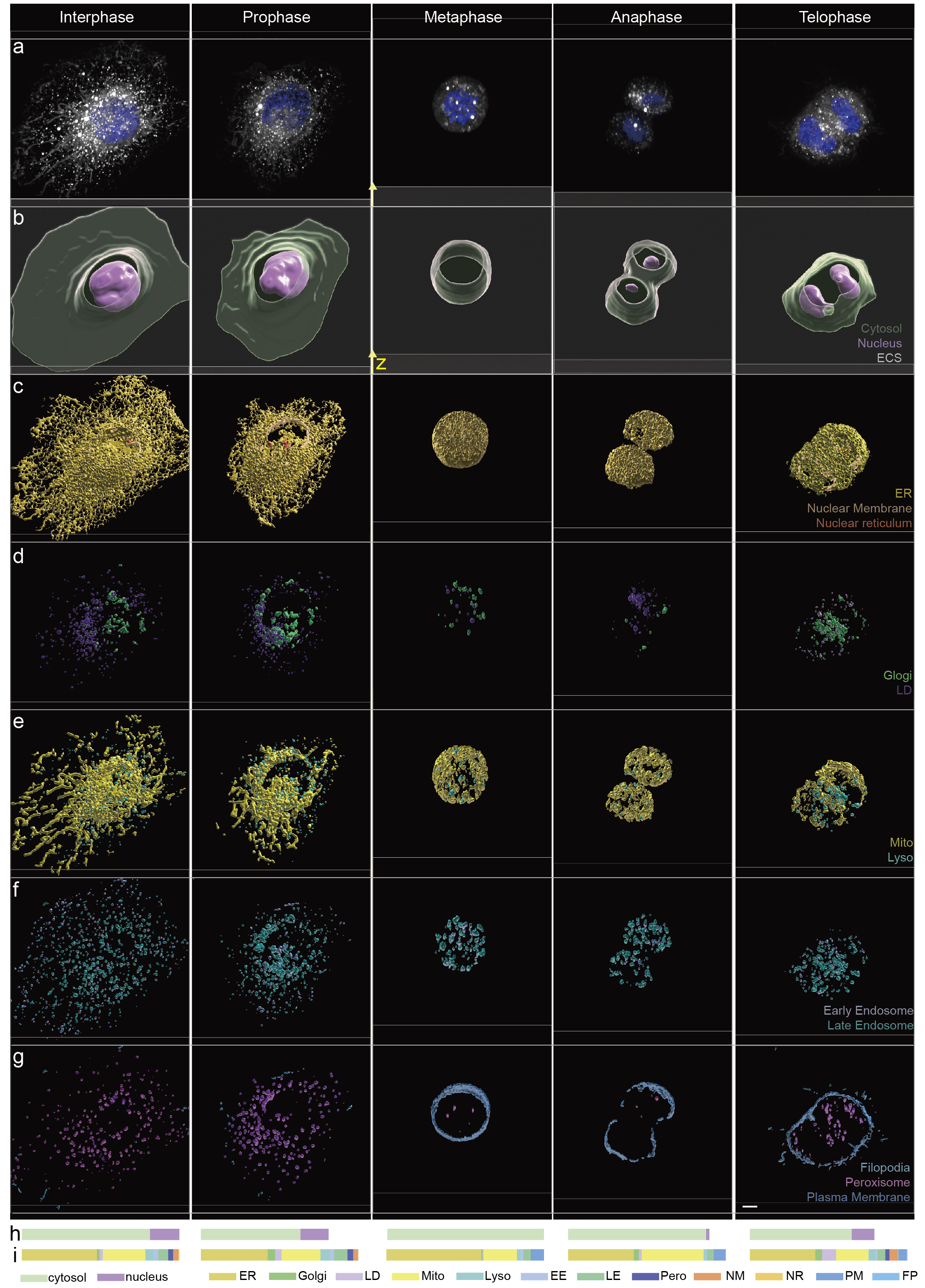
图2细胞不同有丝分裂阶段的多细胞器全景成像。
传统荧光成像技术因“一对一”特异性标记策略的局限性,面临成像通道有限、光谱串扰、标记效率低等问题,难以满足活细胞多细胞器互作研究的需求。本研究提出了一种全新策略:利用通用脂质染料(如尼罗河红)标记多达15种膜细胞器,结合光谱比率成像提取细胞器的“光学指纹”,并通过深度学习网络实现高精度分割与多色成像。这一方法突破了传统荧光成像的技术瓶颈,显著提高了成像速度与通量,为活细胞器互作研究提供了全新工具。
这一成果的出现,标志着活细胞多细胞器成像技术迈入了一个新的阶段。它不仅为细胞生物学研究提供了新的视角和工具,也为理解细胞器在健康和疾病中的作用提供了新的可能性。随着这一技术的进一步发展和应用,科学家将有望更深入地探索细胞的奥秘,为医学研究和疾病治疗带来新的希望。
诺奖得主Eric Betzig教授在最近发表于Nature Methods的评述文章A Cell Observatory to reveal the subcellular foundations of life (中文:揭示生命亚细胞基石的细胞天文台)中,对这一工作进行了高度评价:“从寥寥几个光谱不同的标记物中分类和量化数十种膜结构的性质14,从而解决了活细胞荧光显微镜的主要局限之一。” (...to classify and quantify the properties of dozens of such structures from just a few spectrally distinct markers14, alleviating one of the prime limitations of live fluorescence microscopy.)(图3)
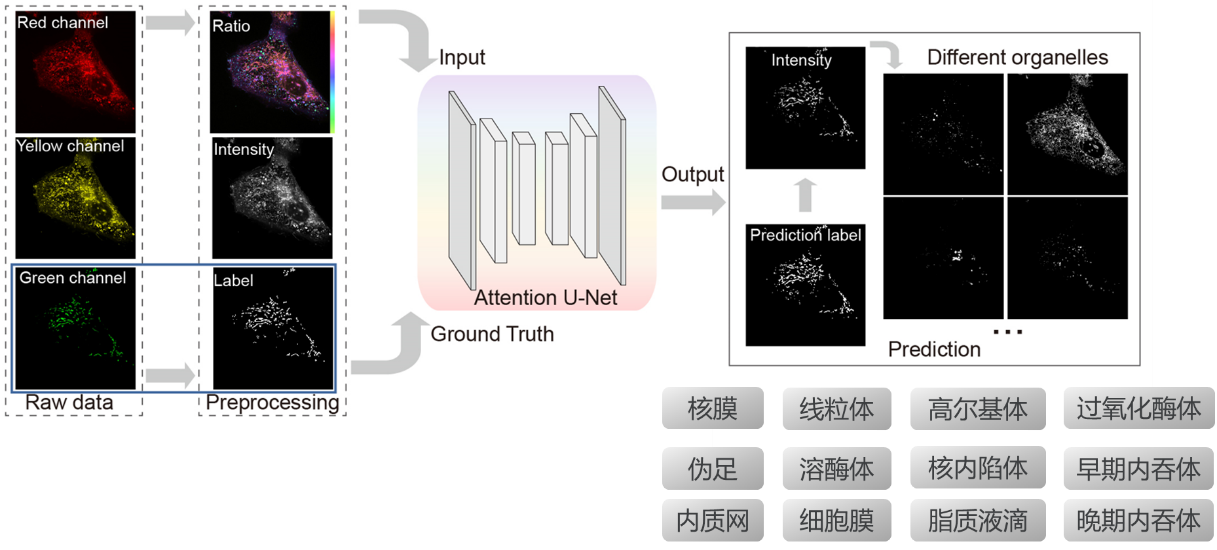


图3结合深度学习方法进一步区分出非特异性标记的不同细胞器结构。诺奖得主Eric Betzig在Nature Methods中对这一工作进行了高度评价。
东方理工大学金大勇教授、北京大学席鹏教授和李美琪博士为该论文共同通讯作者。北京大学已出站博士后,现东方理工大学助理教授张昊,和北京大学李美琪博士为该论文共同第一作者。此外,该工作也得到了中国农业大学傅静雁课题组、北京大学张研课题组、清华大学吴嘉敏课题组以及北京大学生命科学学院仪器平台的重要支持与帮助。本工作得到了科技部重点研发专项和国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41467-025-57877-5
