肿瘤恶液质是晚期癌症患者中常见的病症,患者极度消瘦、食欲不良、肌肉无力、全身衰竭。恶液质不仅给患者的身心带来极大痛苦,而且直接导致约20%肿瘤患者的死亡。有效干预肿瘤恶液质对于改善癌症患者的生活质量、增强对癌症治疗的耐受能力,以及延长患者的生存期都有重要意义。但是肿瘤恶液质的发病机制尚不明确,至今缺乏有效治疗药物,存在重大未满足的临床需求。肖瑞平和胡新立团队最近在Nature Metabolism杂志发表文章(https://doi.org/10.1038/s42255-024-01011-0),揭示了乳酸及其受体GPR81在肿瘤恶液质发生发展中的重要作用,为恶液质的治疗提供了新的思路。
他们发现,肺腺癌患者血液乳酸浓度显著升高,而且与他们的体重下降程度高度相关。此外,患者在肿瘤切除后血乳酸水平显著下降,说明肿瘤是血乳酸升高的主要原因。在正常小鼠中,通过皮下植入渗透压泵递送乳酸提高小鼠血乳酸水平,可以再现典型的恶液质表型,包括体重下降、脂肪和肌肉组织萎缩、脂肪棕色化和脂解增加等。因此,乳酸是肿瘤引起恶液质的重要信号分子。
那么机体如何感知和响应乳酸的变化呢?他们发现乳酸受体GPR81的缺失可以有效缓解肿瘤和乳酸引起的各种恶液质表现。由于GPR81在脂肪细胞中表达水平很高,并且在恶液质发展过程中,脂肪组织的变化早于骨骼肌发生;因此在脂肪细胞中敲除GPR81和GPR81的全身缺失一样,可以抵抗肿瘤引起的体重减少、及脂肪和骨骼肌的消耗,说明脂肪细胞的GPR81是恶液质中机体感受肿瘤来源的乳酸信号的关键分子。
进一步,他们发现乳酸/GPR81依次激活Gβγ-RhoA/ROCK-p38促进脂肪细胞的棕色化,而不是通过经典的PKA途径。因此,在荷瘤小鼠中使用这一信号转导途径上各个节点的抑制剂都可以有效缓解肿瘤引起的体重下降。
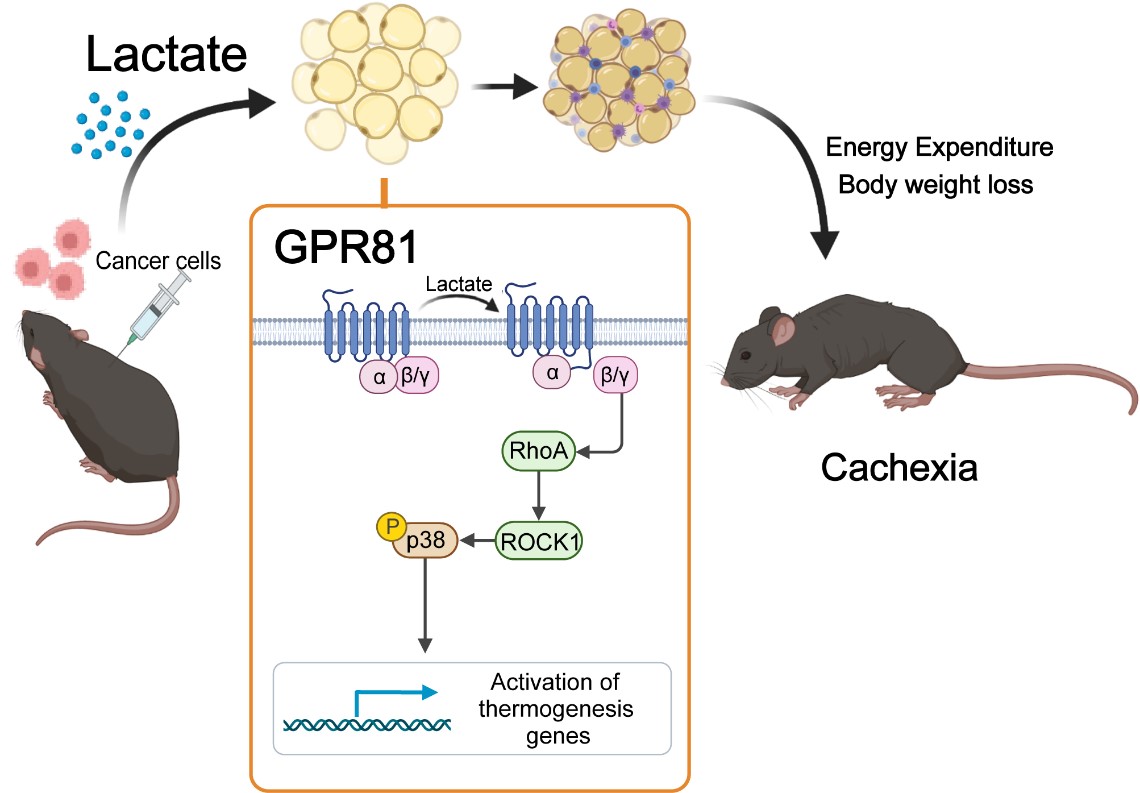
肖瑞平和胡新立团队的上述发现,将肿瘤和脂肪组织的代谢建立起了联系,揭示了乳酸是肿瘤引起恶液质的关键信号分子,乳酸通过其受体GPR81及下游信号转导激活脂肪细胞棕色化,导致脂肪组织的过度消耗,随后引起骨骼肌的萎缩。这些发现为肿瘤恶液质的临床治疗提供了新的靶点。
北京大学未来技术学院博士研究生刘希丹、李施瑾和博士后崔琼花是文章的共同第一作者。肖瑞平教授和胡新立研究员是共同通讯作者。四川达州中心医院的刘杰、曾凡新博士为研究提供了患者样本。文章得到了未来技术学院邱义福教授、生信平台丁晚秋博士和代谢平台权力博士的帮助。该课题得到科技部国家重点研发计划、北大清华联合生命中心、膜生物学国家重点实验室、心血管分子医学北京市重点实验室、北大-南京转化医学研究院的支持。
