胰岛素是体内唯一的降血糖激素,由胰岛β细胞分泌。胰岛β细胞功能失调和胰岛素分泌紊乱是2型糖尿病的核心驱动因素。胰岛素分泌是一个精细的动态调控过程,如何可视化胰岛素分泌过程,揭示胰岛素分泌调控机制是胰岛生物学领域的难点问题。
2021年8月23日,北大未来技术学院、北大-清华生命科学联合中心陈知行研究员团队在Angew. Chem. Int. Ed.在线发表了文章Red- and Far-Red-Emitting Zinc Probes with Minimal Phototoxicity for Multiplexed Recording of Orchestrated Insulin Secretion,(原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202109510)开发了红色及远红锌离子荧光探针,实现了多色、多维、长时程胰岛素分泌监测。

胰岛素在β细胞内与高浓度锌离子(~20 mM)形成晶体结构并共释放,因此采用不透膜的锌离子荧光探针可标记胰岛素/Zn2+晶体,从而指示胰岛素囊泡分泌。北京大学未来技术学院分子医学研究所陈良怡教授团队,开发了一套在胰岛水平实时监测胰岛素囊泡分泌的成像技术:利用不透膜锌离子荧光探针标记Zn2+/胰岛素的晶体结构,结合高速转盘共聚焦显微镜 (spinning-disc confocal microscopy) 快速成像,可在无损胰岛上观察不同β细胞的胰岛素囊泡分泌行为(图1)。但目前已开发的锌离子荧光探针存在许多问题,限制了该技术在生理、病理情况下的应用。1)探针亲和力过高,导致胰岛内非囊泡分泌信号较强;2)探针发射波长较短,无法与其他荧光探针联用;3)探针生物相容性差、光毒性较强,无法长时间记录胰岛素分泌过程。
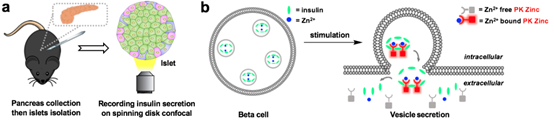
图1. 胰岛素囊泡检测技术原理
传统不透膜锌离子染料(四甲基罗丹明为母体的RhodZin-1)荧光母核亲脂性较强,进入细胞后会产生非特异性染色,并在长时间成像过程中产生光毒性导致细胞凋亡。为提高锌离子探针的生物相容性,陈知行团队将罗丹明母核中位于 N原子上的甲基替换为吗啉环,增强荧光母核的亲水性,从而减少细胞内非特异性染色,降低光毒性,实现胰岛素分泌的长时间监测(30 min)。
此外,团队还通过改变荧光探针螯合基团的化学结构,构建了 5 种具有不同亲和力 (Kd 为 190 nM 至 74 µM)的红色锌离子荧光探针 PKZnR 1-5,它们均可在人源和鼠源的细胞和组织上检测胰岛素分泌。其中PKZnR-1(Kd为 20 mM)最适合在胰岛层面检测胰岛素分泌,可精确反应不同刺激下胰岛素的分泌变化,具有高通量筛选治疗胰岛素分泌异常疾病药物的潜力。PKZnR-5(Kd为190nM)最适合在细胞水平检测胰岛素分泌。
多色荧光探针联用可以进一步揭示β细胞内不同信号(例如Ca2+,线粒体活动等)对胰岛素分泌的调节作用,因此远红探针可进一步拓展该技术的应用。但远红荧光探针的合成往往面临比较大的挑战。陈知行团队采用全新的late-stage N-alkylation合成策略,温和、高效合成地合成了以硅罗丹明为母体的远红锌离子探针PKZnFR。将PKZnFR与细胞核染料 Hoechst(蓝色),可遗传编码钙离子探针 GCaMP6f(绿色),低光毒性线粒体探针 PK Mito Red (红色,陈知行团队2020年发表)联用,可实现四色、3D、长时程检测胰岛素分泌 (movie)。结合荧光图像信号处理和数据分析,发现胰岛β细胞的钙离子内流、线粒体膜电势以及胰岛素囊泡分泌能力具有高度异质性,且三者之间呈现复杂的相互关系(图2)。例如线粒体信号较强的细胞具有较低的分泌能力,分泌能力较强的细胞反而线粒体信号较弱;钙离子内流最强的细胞几乎没有胰岛素分泌,胰岛素分泌较强的细胞并没有更多的钙离子内流。这些现象表明胰岛β细胞具有不同的功能亚群,值得深入挖掘和研究。
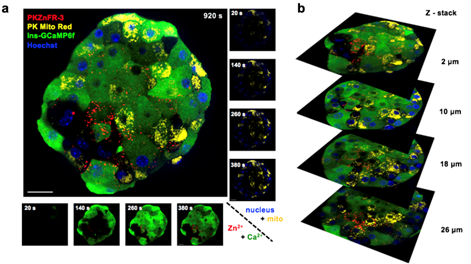
图2. 三维、四色、长时程胰岛素分泌成
综上,本研究通过跨学科交叉合作,为胰岛素分泌过程可视化量身定制了一系列低亲和力、不透膜的红色和远红发射的锌离子探针。多信号、多维、长时程胰岛素分泌成像,揭示了胰岛内不同信号间存在复杂的相互关系,为胰岛内分泌研究进行系统生物学研究提供新的工具和技术,为2型糖尿病生理、病理机制研究提供新的思路和视角。
北京大学未来技术学院分子医学研究所2019级博士生张钧维、博士后彭晓红、研究助理吴云翔(现UW Madison博士研究生)、定量生物学中心博士后任会霞为共同第一作者。未来技术学院、北大-清华生命科学联合中心陈知行研究员为本文的通讯作者。未来技术学院陈良怡教授和定量生物学中心汤超院士为该研究提供了合作与指导。

