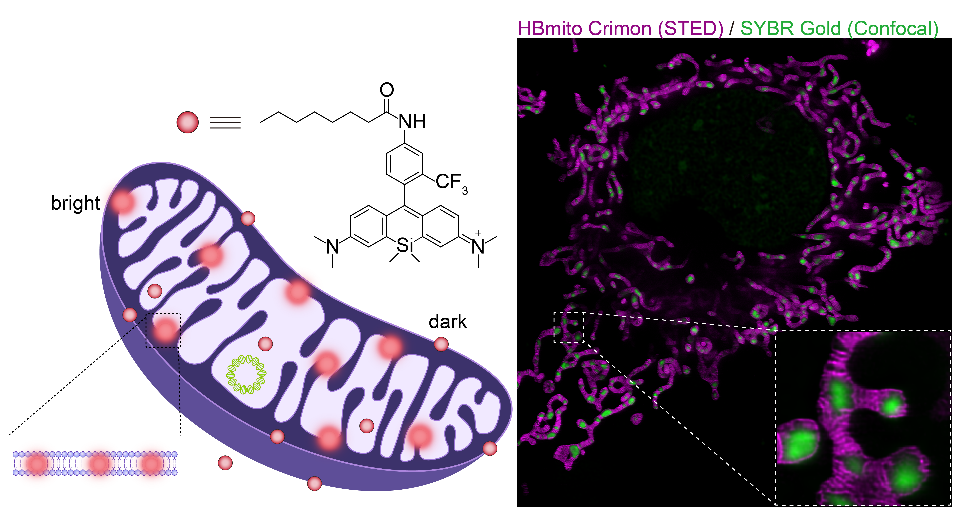
图形摘要
摘要
北京,2024年5月27日—— 在细胞的微观世界中,线粒体如同精巧的发电站,通过调控在线粒体内膜(嵴)上的化学反应为生命活动提供必需的能量。然而,这些细胞内的微小细胞器不仅关乎能量转换,更与细胞的生长、稳定、信号传导、甚至细胞凋亡等息息相关。线粒体这些重要而又独特的性质源于线粒体内膜包裹的专属遗传信息-线粒体DNA(mtDNA)。科学家渴望进一步探究mtDNA在线粒体网络结构中的分布规律、mtDNA与线粒体嵴相互作用关系。北京大学未来技术学院席鹏团队与合作者通过开发一种新型荧光探针HBmito Crimson,为我们揭开了线粒体嵴与其内部DNA(mtDNA)之间神秘互动的面纱,相关工作发表于Light: Science and Applications。
在细胞内部,线粒体作为细胞的“发电站”,扮演着至关重要的角色,不仅负责能量的产生,还涉及细胞的增殖、稳态维持以及调控细胞凋亡等关键信号通路。线粒体嵴作为内膜的一部分,其结构细微且复杂,对于维持线粒体功能至关重要。而线粒体自带遗传密码,类似人体中的一个器官但具有独立的DNA,因此其来源与功能就显得更加神秘。线粒体DNA(mtDNA)位于线粒体基质中,包含37个基因以及编码14种线粒体相关蛋白,在ATP的生产中扮演了重要作用。mtDNA由蛋白质包装形成类核,由于线粒体嵴作为屏障,类核的运动在线粒体中受到限制。嵴重塑参与下的线粒体融合和裂变对于mtDNA的分布和维持至关重要。然而,在这个过程中,嵴排布的动态特性促进mtDNA在整个线粒体网络中分布的机制仍然未被充分探索。
线粒体的直径一般在500纳米左右,嵴间距一般小于70纳米,传统显微镜技术没有办法观察到该动态过程。超分辨显微镜,特别是受激辐射损耗超分辨显微镜(STED)的发展,使得线粒体嵴的动态可视化成为可能,该技术提供的空间和时间分辨率分别约为50纳米和每秒1帧。然而,STED需要高强度的损耗光束来提升分辨率,要求标记染料在特异性靶向线粒体内膜的情况下,同时具有高亮度和高受激发射截面(即低饱和功率)的特点。传统的线粒体内膜标记染料在STED下只能维持几帧,新开发的一些染料在动态成像时间尺度上也满足不了观察需求。
在这一研究领域,北京大学与河北大学的联合研究团队开发了一种名为HBmito Crimson的新型荧光探针(其中HB一语双关,既代表超分辨染料的重要特性高亮度High-Brightness,也代表染料发明地河北HeBei)。该探针具有高亮度,卓越的光稳定性、脂膜荧光性和低STED饱和功率等特点。利用这种探针,研究团队成功实现了超过500帧的连续低功率成像,以40纳米的空间分辨率观察了内膜动态(图1)。
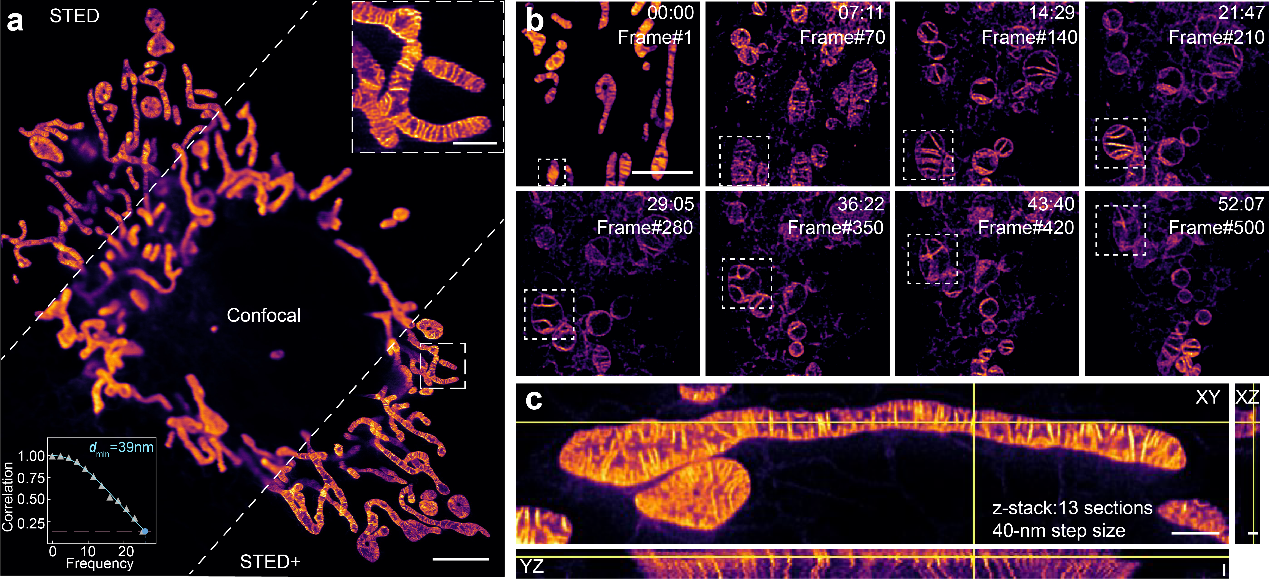
图1 用HBmito Crimson染色的线粒体内膜多维成像结果。(a)共聚焦,STED和STED反卷积结果对比展示;(b)线粒体连续长时程成像,成像帧数500帧;(c)线粒体的3D-STED成像。
通过使用HBmito Crimson和SYBR Gold对内膜和mtDNA进行了延时双色STED/共聚焦成像,发现mtDNA在整体均匀分布的情况下倾向于在线粒体的尖端或分支点聚集。线粒体和相互连接的线粒体网络之间mtDNA分布存在差异,说明不同大小的线粒体可能发挥不同的功能。在线粒体动态过程中(图2),观察到线粒体网络是通过融合事件和新分支的产生而形成的,并且作者首次可视化了在线粒体形成分支时的嵴动态和mtDNA分布变化。有趣的是,作者发现融合事件往往发生在mtDNA附近,可能因为mtDNA所在的嵴簇之间的空隙基质密度较低,嵴排列松散,嵴重塑过程中受到的压力较小。这种密切关联可能还使得mtDNA在融合过程中能够在不同的线粒体之间有效传输。此外,对线粒体分裂的观察揭示了mtDNA复制和分裂位点之间的空间联系,从而使遗传物质能够在整个线粒体网络中正确分离和均匀分布。
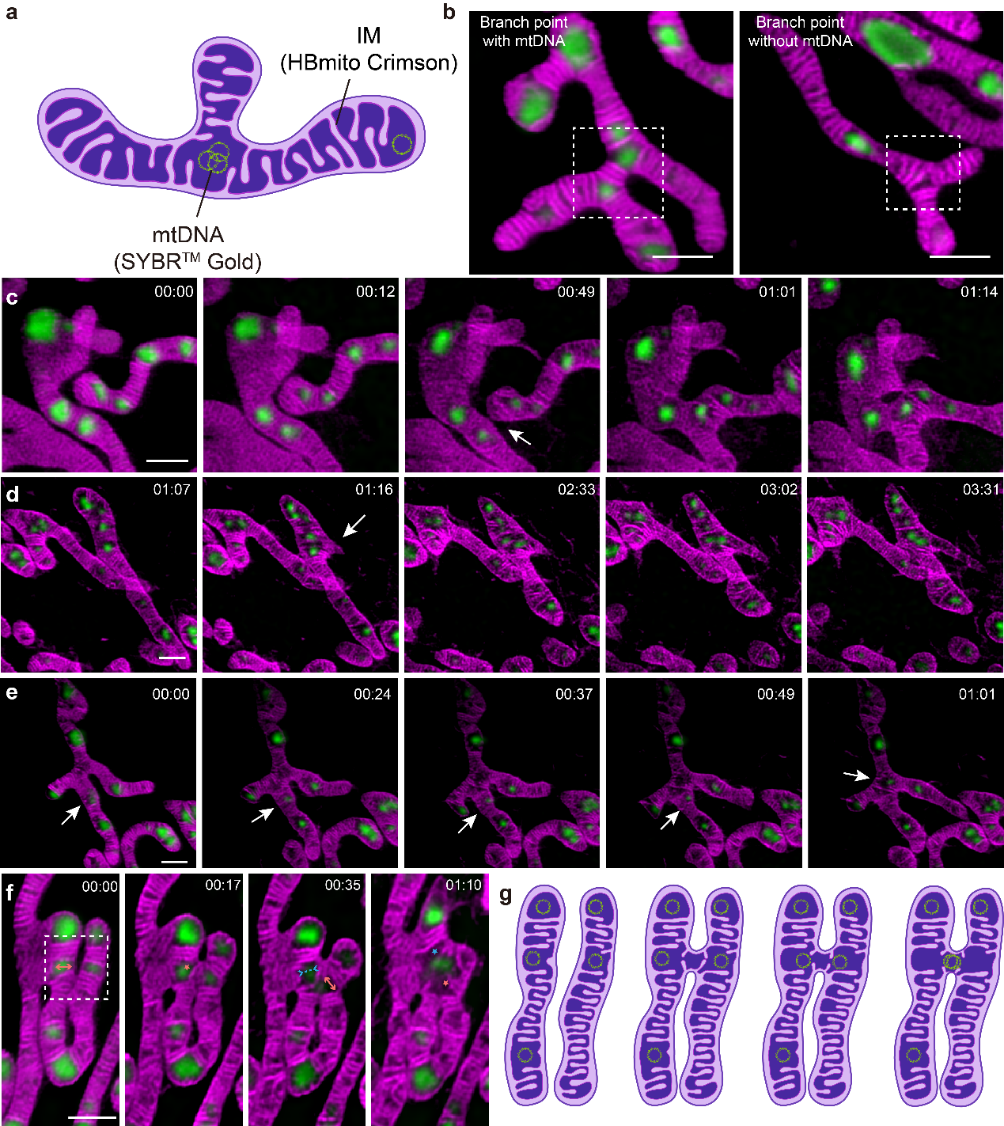
图2 与mtDNA相关的线粒体动力学成像。(a)卡通展示mtDNA倾向于分布在尖端和分支点;(b)分支点处存在mtDNA和不存在mtDNA时的情况;(c)线粒体融合形成分支点;(d)新分支的出现形成分支点;(e)线粒体分支上的mtDNA移动到分支点;(f,g)线粒体融合中的嵴动态展示。
mtDNA在维持嵴结构中起着重要作用。反之,维持mtDNA分布也需要正常的嵴动力学。在细胞凋亡和铁死亡的情况下,嵴结构被破坏,导致mtDNA分布紊乱。作者观察到了细胞凋亡后期内膜疝出和mtDNA逃逸的动态过程,以及铁死亡时线粒体的皱缩、碎片化以及mtDNA的会聚,反映了与细胞死亡模式相关的明显形态变化和线粒体损伤。
综上所述,这一研究结果以40nm的超高时空分辨率揭示了线粒体膜动态与mtDNA分布之间错综复杂的关系。先进成像技术与新型线粒体内膜探针的结合,使得活细胞STED低光毒性成像成为可能,并展示了新技术在下一代线粒体研究中的巨大潜力。理解这些机制将有助于揭示线粒体在细胞生理学、人类疾病和衰老中的作用。
主要作者介绍
北京大学未来技术学院博士生任伟、河北大学化学与材料科学学院硕士生盖希川为共同第一作者。北京大学未来技术学院席鹏教授、河北大学化学与材料科学学院高保祥教授、北京大学生命科学学院单春燕高级工程师为本文的共同通讯作者。值得一提的是,在本文作者中,第一作者任伟、盖希川,通讯作者单春燕、席鹏均为党员。而Crimson探针的深红色,也折射出作者们致力科技革新的创新精神。
本工作受到科技部重点研发计划、国家自然科学基金的支持,也得到北京大学国家蛋白质科学中心、Abberior中国公司和光飞纳科技公司的帮助。HBmito Crimson探针产品目前由MedChemExpress (MCE)公司负责产品推广(https://www.medchemexpress.cn/hb-imm-d-red.html)。

任伟,北京大学未来技术学院博士研究生,导师席鹏教授,主要研究方向为超分辨显微成像技术(STED、图像扫描显微镜)以及线粒体动态成像,相关研究成果发表在Light: Science & Applications和eLight等,授权发明专利一项,在FOM和CIOP等国际会议上进行口头报告,获北京大学校长奖学金等。

盖希川,2023年在河北大学化学与材料科学学院获得硕士学位,师从高保祥教授,主要从事线粒体超分辨成像、荧光探针的设计合成以及超分辨成像的生物应用研究,相关成果发表在Light: Science & Applications和Chemical Communications等。

单春燕,北京大学生命科学学院高级工程师,国家蛋白质科学研究中心北京大学分中心和生命学院公共仪器中心光学成像平台负责人,主要从事光学显微成像技术研究及应用。2007年本科毕业于北京理工大学,2013年博士毕业于北京大学细胞生物学专业。自2013年起主要从事显微成像技术相关的平台支撑服务,负责新型荧光显微成像技术的开发和应用,包括超分辨荧光成像、多维荧光成像技术、活细胞成像、新型荧光标记技术、超多标组织病理技术等;在活细胞超分辨成像、多维荧光标记和成像技术、单细胞空间组学等方向取得进展,相关成果发表在Nature Communication,Nanophotonics,Scientific Reports等期刊。

高保祥,河北大学化学与材料科学学院教授,博士生导师,中国化学会高级会员。1998年本科毕业于北京理工大学,2006年博士毕业于中国科学院长春应用化学研究所,同年到河北大学工作至今。2011年获河北省杰出青年基金资助,2012年入选教育部新世纪优秀人才支持计划。2015年-2016年在德国布伦瑞克工业大学生命科学联合研究中心Philip Tinnefeld教授课题组学习单分子荧光与超分辨成像技术。迄今为止,在Advanced Functional Materials,Analytical Chemistry,Organic Letters等知名学术期刊发表研究论文40余篇。

席鹏,北京大学未来技术学院博雅特聘教授,国际先进材料学会会士(FIAAM),国家杰出青年科学基金获得者,科技部重点研发计划首席科学家。致力于超分辨显微成像新技术的研究。现担任Advanced Photonics 等五本国际学术期刊的编委。在Nature, Nature Methods等国际期刊发表SCI收录期刊论文90余篇,总影响因子大于700,被引超过6000次。2016年获得中国光学重要成果奖。2022年获得广东省自然科学二等奖(排名第二)。已授权美国专利3项,中国专利19项,编辑专著2部。多次被OPTICA(原OSA)和SPIE组织的国际会议邀请作大会邀请报告。
原文链接:https://www.nature.com/articles/s41377-024-01463-9
