2023年8月17日,北京大学未来技术学院的陈知行课题组和北京大学化学与分子工程学院邹鹏课题组在 Proc. Natl. Acad. Sci. U.S.A. 杂志在线发表了最新合作研究成果“ Orange/far-red hybrid voltage indicators with reduced phototoxicity enable reliable long-term imaging in neurons and cardiomyocytes ”,他们合成了光稳定性良好的环辛四烯(COT)修饰的花菁染料,搭配灵敏度优异的复合型膜电位探针HVI(hybrid voltage indicator),将其升级为新一代低光毒性探针。其中,橙色荧光探针HVI-COT-Cy3 可对神经元进行持续30 min的膜电位记录,还能有效鉴定药物对神经元和心肌细胞电生理的影响;此外,远红色探针HVI-COT-Cy5可与绿色荧光探针联用,实现神经膜电位与钙信号连续15 min的并行检测。

揭开大脑奥秘的关键在于研究细胞间的通讯机制,而理解细胞间电通讯的核心在于测量并解析细胞间的电信号。相比传统膜片钳技术,细胞膜电位成像具有非侵入式检测、高检测通量等优势,逐渐在检测可兴奋细胞电信号的时空动态变化方面崭露头角。基于电压敏感蛋白质与小分子荧光染料复合型结构的荧光膜电位探针,在电压灵敏度、光稳定性和细胞特异性等方面展现出明显优势,极大地促进了光学成像在检测神经活动方面的应用。
然而,荧光成像所需的激发光对活细胞存在固有光毒性,而膜电位成像为了获取足够高的信噪比,需要更高的激发光强度,相应导致更明显的光毒性和更迅速的光漂白,从而大大限制了膜电位成像的记录时长。对于神经科学研究者和药物开发者而言,无论是研究突触可塑性、动物行为节律,抑或是表征药理毒性,往往需要连续或累积进行长时间的电生理记录,这极大考验了膜电位探针的光稳定性和光毒性。
邹鹏课题组长期开发检测生物信号的化学探针,率先提出“复合型膜电位探针”概念,使用生物正交的化学标记策略将荧光染料与视紫红质蛋白偶联,并通过电致变色效应实现细胞膜电位观测( Nat. Chem. 2021, 13, 472-479)。然而,他们在实验中发现基于化学染料的荧光探针很难避免的对神经元造成光毒性损伤。陈知行课题组一直致力于根据化学原理量身定制化学分子,解决生物学研究中“技术卡脖子”问题。2020年,陈知行课题组发表文章( Chem. Sci. 2020, 11, 8506-8516),应用三线态淬灭剂环辛四烯(COT)偶联策略合成了线粒体探针,首次在活细胞水平上展示了低光毒性探针在超分辨成像领域的潜力。因此两个课题组一拍即合,针对膜电位成像中光毒性这一痛点展开了联合攻关。团队通过合成COT 修饰的花菁染料COT-Cy3和COT-Cy5,开发了更温和的新型膜电位探针HVI-COT,显著改善了膜电位成像的光毒性和光稳定性(图1)。
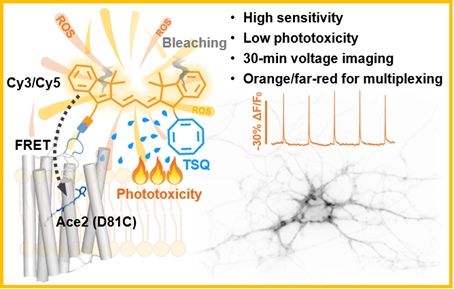
图1 低光毒性复合型膜电位探针概念图
实验表明,HVI-COT-Cy3灵敏度(-33.4±0.8% ΔF/F0 per AP)超越HVI-Cy3,创下橙色波段膜电位探针灵敏度新高。凭借着优秀的光稳定性和轻微的光毒性,HVI-COT-Cy3可对神经元连续进行30 min 的膜电位记录,并能在该时间窗口内鉴定多种药物对神经元动作电位爆发频率影响(图2)。值得一提的是,HVI-COT-Cy3的光稳定性是同类探针Voltron2525的40多倍,光毒性也明显低于Voltron2525。
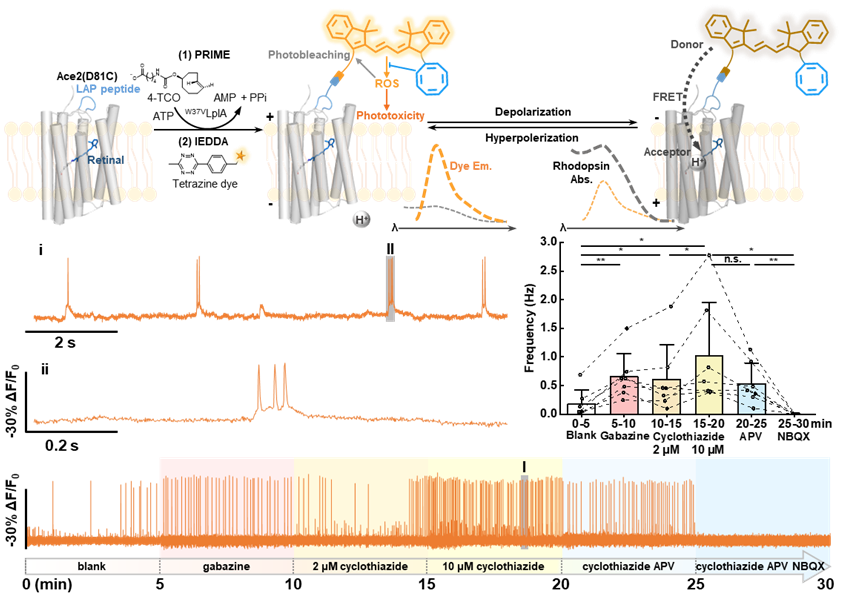
图2 HVI探针荧光标记方法、膜电位响应原理,以及长时间记录神经元电活动结果
此外,HVI-COT-Cy5可搭配绿色荧光钙探针GCaMP6s,在神经元和心肌细胞中进行了连续15 min的双色成像。多色成像有助于研究者了解多种动态变化的生理信号之间的联系和差异。未来,HVI-COT-Cy5有望搭配绿色钙探针,以双重指标评价药物的神经或心肌毒性。
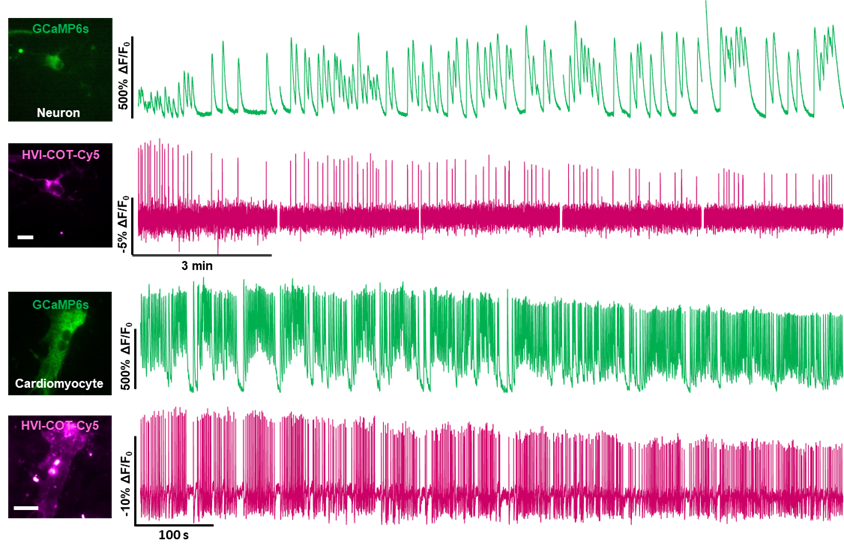
图3利用HVI-COT-Cy5 与GCaMP6s 同步记录神经元和心肌细胞电-钙信号
综上,本文通过对化学荧光染料的修饰改性,针对膜电位成像领域的光毒性痛点,发展了更温和的能够长时间记录神经元和心肌细胞电信号的高性能荧光探针,实现了长时程多色成像和药理学检测。近年来,功能性膜电位成像应用深度和广度不断拓展,朝着更多样的研究体系、更深层的在体观测区域、更长的记录时长迈进。预计HVI-COT系列探针将成为研究者更可靠地评估药物对神经元或心肌细胞的电生理影响的重要工具。
北京大学化学与分子工程学院博士刘书彰,北京大学前沿交叉学科研究院、北大-清华生命联合中心博士生凌靖为该论文的共同第一作者。北京大学未来技术学院陈知行研究员和北京大学化学与分子工程学院邹鹏研究员为该论文的共同通讯作者。该工作得到了北京市科委、国家自然科学基金委、科技部、生物有机与分子工程教育部重点实验室、北京分子科学国家研究中心、北京大学IDG/麦戈文脑科学研究所和北大-清华生命科学联合中心的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2306950120
