长期以来,人们主要依赖模式动物来研究人类器官发育和疾病发生的机制,但由于物种差异性,很多发现对人类并不适用,因此亟需人源实验模型来进行人体器官的模拟。物理学家费曼说,“凡我不能创造的,我就不能理解。”人类胚胎干细胞(hESC)的成功建立和发展,使得在体外模拟人体器官发育成为可能[1]。而传统的平面2D培养体系无法重现类似体内组织的基本特征,如组织结构、细胞互作和细胞类型的多样性。近年来发展的类器官培养系统在一定程度上弥补了这些缺陷[2]。经过许多科学家的努力,脑、肠、胃、肝、肾和肺等多种组织类型的类器官已被成功构建,并被广泛应用于疾病建模、药物测试和研究人类发育及进化等方面[3]。然而,当前类器官技术仍存在许多限制其发展和应用的问题,包括培养成本高、操作步骤繁琐、样品间均一性和批次间可重复性低等。这些问题阻碍了类器官的标准化培养,难以实现自动化和高通量研究。
2023年8月8日,北京大学未来技术学院汪阳明实验室及合作者于Biofabrication在线发表了题为Highly reproducible and cost-effective one-pot organoid differentiation using a novel platform based on PF-127 triggered spheroid assembly的文章,该研究首次发现在细胞培养基中添加低浓度Pluronic F-127(PF-127),能够在造价极低的塑料培养板中促进人胚胎干细胞形成尺寸高度均一的球体。基于此发现,该研究团队成功开发了一种操作简便、可重复性高的新型类器官分化策略,并成功构建了肝、肾、脑和肺类器官,与其他方法相比,成本大幅降低80%以上,为推进类器官基础和应用研究提供了一个高效实用的平台。文章链接:https://doi.org/10.1088/1758-5090/acee21。
PF-127是一种聚氧乙烯-聚氧丙烯醚非离子型三嵌段共聚物,一般用作药物制剂辅料,也被用来处理微流控器件的表面,以减少细胞或蛋白的黏附[4, 5]。研究者发现在培养基中仅添加低浓度PF-127(0.0125%,甚至低至0.0005%,而处理微流控器件的浓度则高达1-4%),就可让人胚胎干细胞在普通U型板的培养孔中形成尺寸高度均一的单一球体(图1)。研究者发现培养基中低浓度PF-127的作用与传统认为的作用机制无关,结合RNA-Seq分析,初步显示低浓度PF-127可能通过瞬时作用调节细胞中蛋白质靶向膜的通路,从而改变细胞表面的黏附分子成分来起作用。
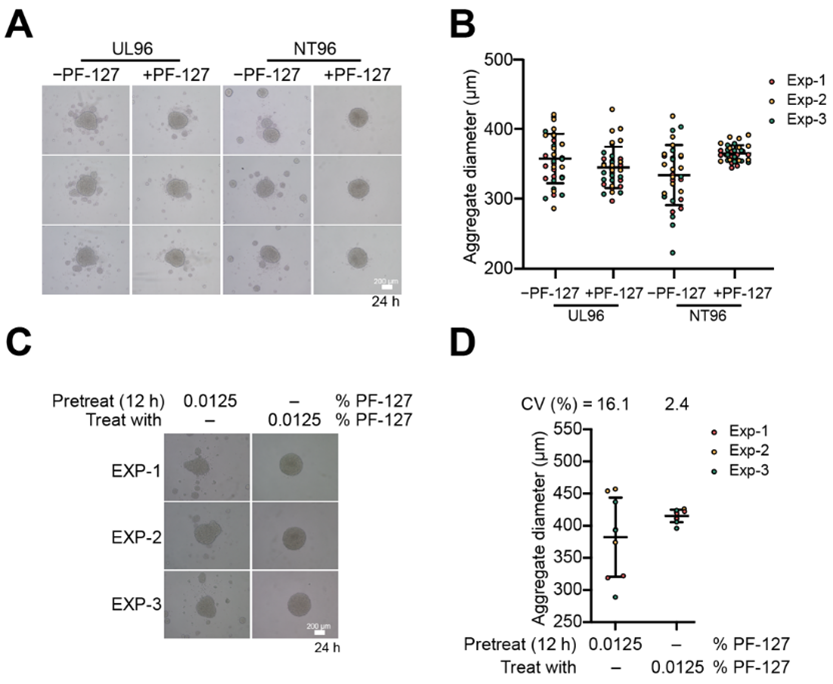
图1:低浓度PF-127的添加促进hESC在普通培养板中聚集成球体
在获得高度均一的人胚胎干细胞球体的基础上,研究者通过在培养基中添加促进干细胞向肝脏类器官分化的小分子和蛋白,在同一个培养孔中,即可获得高度分化的肝脏类器官,并在形态、肝脏特异标志物的表达量上都具有很好的可重复性,高于其他分化方法。用同样的思路,研究者成功构建了肾、脑和肺类器官,证明该方法具有普适性,能够应用于不同胚层类器官的构建(图2)。
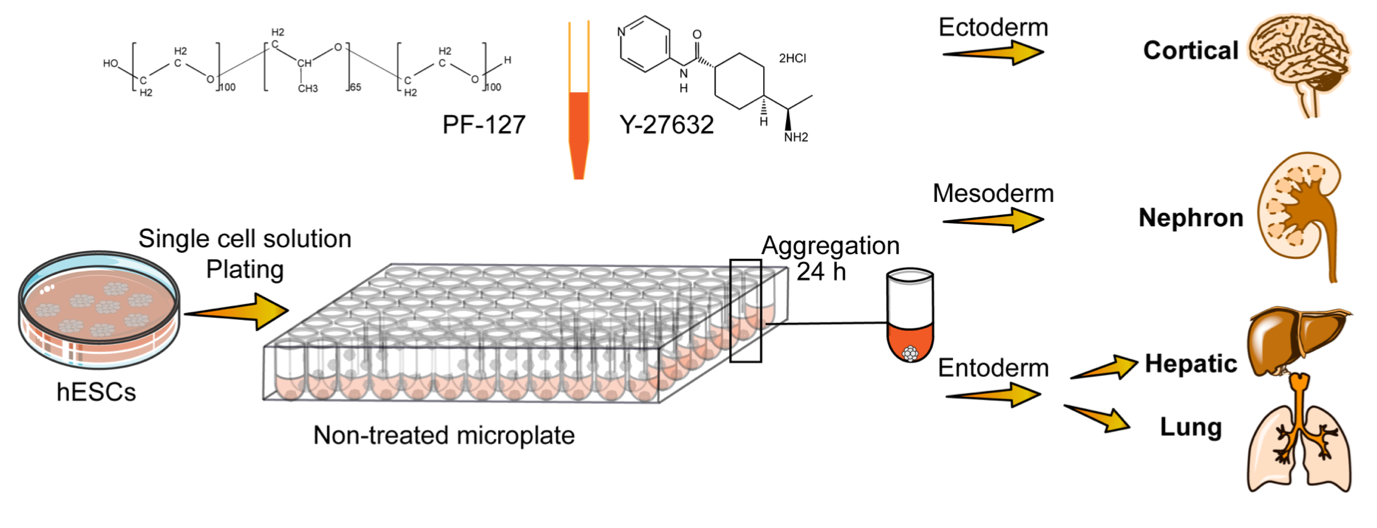 图2:新类器官平台可以用来构建人胚胎干细胞来源的脑、肾、肝和肺类器官
图2:新类器官平台可以用来构建人胚胎干细胞来源的脑、肾、肝和肺类器官
基于这一操作简便、可重复性高的类器官平台,研究者进一步探索解决类器官自动化培养、高通量筛选等难点问题。将微流控技术与这一类器官平台相结合,实现了单孔内类器官的自动化培养,从而消除了潜在有害的人为干预。接着,研究者通过构建来自不同胚层的类器官,评估了常用抗生素药物对不同组织类器官的毒性以及不同递送试剂的组织特异性。最后研究者展示了该平台可以用于研究组织特异性基因调控。他们关注一个经典长非编码RNA(lncRNA) NEAT1 在器官发育中的作用,并应用该类器官平台获得了 NEAT1 敲除的不同组织类型类器官。通过RNA-Seq分析,他们发现该lncRNA在脑组织中可能特异抑制免疫基因的表达,而在其他组织中则没有此功能。这些结果展示了新发展的类器官平台在高通量筛选和研究组织特异性基因调控方面,具有潜在的应用价值。
总之,该研究为类器官培养提供了一个新的普适性平台,解决了目前类器官培养成本高、流程复杂、异质性高及重复性低的难题,为高通量筛选、疾病建模及研究人类器官发育提供了新的技术平台。
北京大学未来技术学院分子医学研究所博士后张晓姗为论文第一作者。分子医学研究所汪阳明教授为本文的通讯作者。该研究得到了北京大学黄岩谊、程强实验室的指导与帮助;研究由国家自然科学基金委和国家重点研发计划专项资助。
[1] Thomson J A, Itskovitz-Eldor J, Shapiro S S, Waknitz M A, Swiergiel J J, Marshall V S and Jones J M 1998 Embryonic stem cell lines derived from human blastocysts Science 282 1145-7
[2] Lancaster M A, Renner M, Martin C A, Wenzel D, Bicknell L S, Hurles M E, Homfray T, Penninger J M, Jackson A P and Knoblich J A 2013 Cerebral organoids model human brain development and microcephaly Nature 501 373-9
[3] Rossi G, Manfrin A and Lutolf M P 2018 Progress and potential in organoid research Nat Rev Genet 19 671-87
[4] Dadgar N, Gonzalez-Suarez A M, Fattahi P, Hou X N, Weroha J S, Gaspar-Maia A, Stybayeva G and Revzin A 2020 A microfluidic platform for cultivating ovarian cancer spheroids and testing their responses to chemotherapies Microsyst Nanoeng 6
[5] Lee S, Kim S, Ahn J, Park J, Ryu B Y and Park J Y 2020 Membrane-bottomed microwell array added to Transwell insert to facilitate non-contact co-culture of spermatogonial stem cell and STO feeder cell Biofabrication 12
