乙型肝炎病毒(HBV)长期感染会显著增加肝硬化和肝细胞癌等疾病的风险。根据世界卫生组织2022年的数据,全球约有2.54亿人患有慢性乙肝,其中110万人死于HBV相关疾病。中国作为全球乙肝负担最重的国家之一,目前有患者7970万人,这对我国医疗系统构成了严峻挑战。
HBV是一种包膜病毒,其包膜上唯一的蛋白质——乙型肝炎病毒表面抗原(HBsAg)在感染中扮演关键角色。HBsAg的胞外区域形成抗原环(AGL)结构域,该区域通过与细胞表面的硫酸肝素蛋白聚糖(HSPG)结合,介导病毒颗粒与宿主细胞的粘附,进而协助PreS1蛋白与NTCP受体结合以启动病毒入侵。此外,AGL也是人体免疫系统的主要识别目标,大多数HBV中和抗体通过结合该区域发挥作用。因此,AGL区域频繁发生免疫逃逸突变(如传播最广的G145R突变),导致病毒突破抗体中和而进行感染。
尽管AGL区域在HBV感染和人体免疫应答中至关重要,但此前关于HBsAg形成的亚病毒颗粒(SVP)的研究均未能成功观测到该区域的高分辨率结构1-3,这主要因为AGL区域分子量较小,且相对于跨膜区有一定摆动。2020年,研究者借助HBV中和抗体H015首次获得AGL中T140-N146肽段的晶体结构4,但该片段仅包含7个氨基酸且无任何二硫键结构信息,远未揭示AGL的全貌。
2025年6月17日,北京大学未来技术学院分子医学所、北京-清华生命科学联合中心的陈雷课题组在《Cell Discovery》期刊上发表了题为《Structural Polymorphism of the Antigenic Loop in HBV Surface Antigen Dictates Binding of Diverse Neutralizing Antibodies》的文章,链接:https://www.nature.com/articles/s41421-025-00803-2。该研究首次揭示AGL可以通过两种完全不同的二硫键连接模式形成了两种结构不同的蛋白,并揭示这两种HBsAg被对应的中和抗体识别的机制。
陈雷课题组通过生化实验发现两类HBV中和抗体可分别识别完全不同的HBsAg蛋白。陈雷课题组使用相应的中和抗体分别纯化这两种不同的HBsAg蛋白,并进行了冷冻电镜单颗粒分析,最终解析了它们的结构。其中一种被命名为AGLTypeA,其二硫键排布呈非对称模式;另一种命名为AGLTypeB,其二硫键排布基本呈现对称模式(除一对未被观测的二硫键外)。两种亚型的结构差异在于不同的二硫键连接模式改变了AGL表面氨基酸的空间分布,进而形成不同的抗体结合界面。
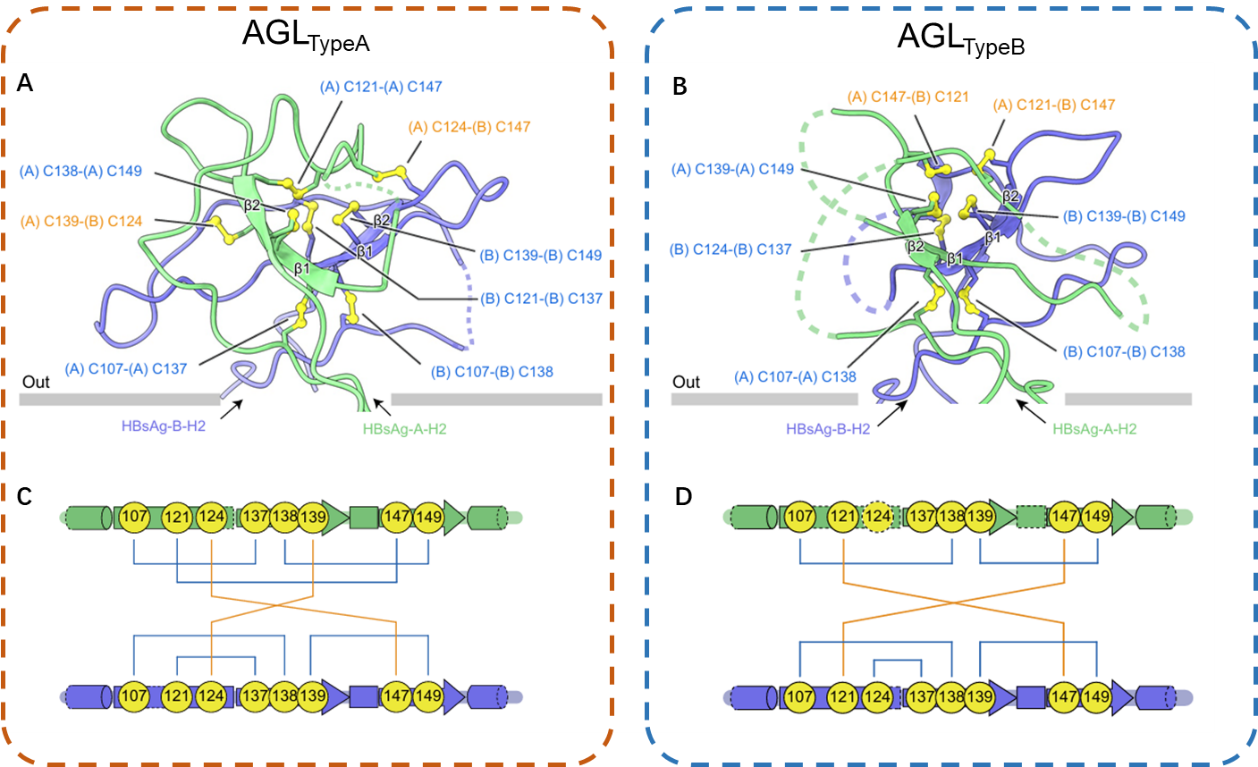
图1 两种AGL结构亚型的原子模型和二硫键链接示意图比对。
陈雷课题组进一步分析了结构解析中使用的三种中和抗体:HBC34 (Type A)、H006 (Type B)和GC1102(Type C)的表位特征,发现GC1102抗体的结合位点在两种HBsAg中均存在,并且在大部分逃逸突变(包括G145R)之外。这一发现与GC1102可广谱识别HBsAg免疫逃逸突变的实验现象高度吻合5。
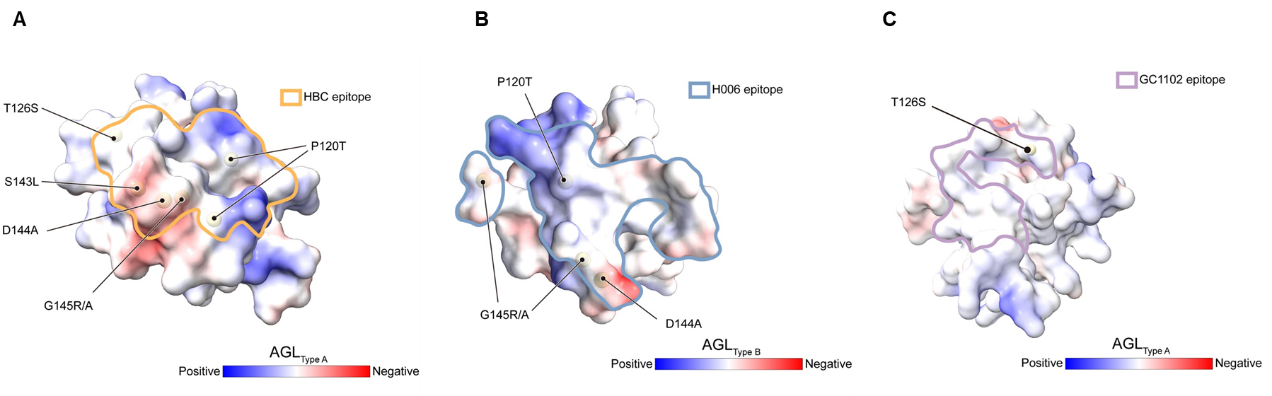
图2 三种中和抗体在AGL上表位和常见免疫逃逸突变位点位置关系的示意图。
综上所述,这项研究揭示了HBsAg蛋白在AGL区域的结构多态性,阐明了HBV免疫逃逸的分子机制,为新型疫苗和广谱抗体的研发提供了关键的理论依据。本项工作主要由北京大学未来技术学院陈雷课题组博士生何潇完成,博士后康云路和博士生陶薇羽、徐家璇、刘啸宇也参与了本项研究。该工作的冷冻电镜样品制备、筛选和采集在北京大学电镜室和生科院冷冻电镜平台完成,得到了李雪梅、郭振玺、秦昌东和王国鹏等人的帮助。项目的数据处理得到了北大-清华生命科学联合中心“北极星”高性能计算平台及未名超算平台的硬件和技术支持。
参考文献:
1Liu, H., Hong, X., Xi, J., Menne, S., Hu, J. & Wang, J. C. Cryo-EM structures of human hepatitis B and woodchuck hepatitis virus small spherical subviral particles. Sci Adv 8, eabo4184 (2022). https://doi.org:10.1126/sciadv.abo4184
2Wang, Q. et al. Inherent symmetry and flexibility in hepatitis B virus subviral particles. Science 385, 1217-1224 (2024). https://doi.org:10.1126/science.adp1453
3He, X., Kang, Y., Tao, W., Xu, J., Liu, X. & Chen, L. Structure of small HBV surface antigen reveals mechanism of dimer formation. Cell Discov 11, 6 (2025). https://doi.org:10.1038/s41421-024-00768-8
4Wang, Q. et al. A Combination of Human Broadly Neutralizing Antibodies against Hepatitis B Virus HBsAg with Distinct Epitopes Suppresses Escape Mutations. Cell Host Microbe 28, 335-349 e336 (2020). https://doi.org:10.1016/j.chom.2020.05.010
5Jeong, G. U. et al. A recombinant human immunoglobulin with coherent avidity to hepatitis B virus surface antigens of various viral genotypes and clinical mutants. PLoS ONE 15, e0236704 (2020). https://doi.org:10.1371/journal.pone.0236704
