“我是谁?我从哪里来?要到哪里去?”是发育生物学探究细胞命运的核心问题。从单个受精卵到形成由200多种不同细胞类型组成的个体,离不开细胞的增殖及细胞命运的分化。囊胚发育过程中,细胞的分布和形态发生显著的变化,产生了第一次细胞命运决定,形成了内细胞团(inner cell mass, ICM)和滋养层细胞(trophectoderm, TE)。第一次命运决定由包括各种分子在内的多因素共同驱动发生,如Hippo通路在ICM和TE细胞中影响不同基因表达状态【1】,分子水平的不对称分布【2】等。囊胚发育中细胞致密化及囊胚腔的形成,生物力学在第一次命运决定中起着推动作用。
2016年,Maitre等人发现顶端区域的不对称分裂导致细胞收缩性的差异,从而促进细胞命运的特化【2】。2019年,Chan等人发现囊胚发育过程中,液腔压力影响TE细胞的分裂模式,进而调控了细胞分化和命运决定【3】。然而已有研究方法仅能测量局部区域或部分细胞(TE),无法探究胚胎内部比如ICM受到的机械力。此外,何种机械力调控ICM细胞命运也尚不得知。早期胚胎发育是一个快速、动态的过程,已有研究的方法尚不能长时程实时报告或检测力与细胞谱系的关系。
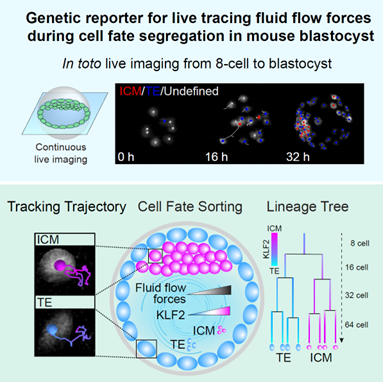
2023年8月3日,北京大学未来技术学院、北京大学-清华大学生命科学联合中心何爱彬团队于 Cell Stem Cell 在线发表了题为“Genetic reporter for live tracing fluid flow forces during cell fate segregation in mouse blastocyst development”的文章,该研究发现在早期哺乳动物囊胚腔中存在流体力,并鉴定出可实时报告流体力大小的因子——KLF2,实现了囊胚形成过程中流体力的测量和动态长时程细胞谱系的绘制,证明流体力调控了第一次细胞命运决定,为胚胎发育与生物力学研究提供了新视角。

研究者首先向囊胚腔内显微注射荧光小球,观测到相对于甲醛固定胚胎,发育中的囊胚腔内存在有方向性的荧光小球运动。通过对高密度的荧光小球进行轨迹定量计算,发现囊胚腔内的剪切力为0.15 dyne/c㎡。随后,研究者建立了一套模拟流体力的方式,通过单细胞转录测序,发现胚胎干细胞干性相关基因KLF2可能具有快速响应流体力的能力。研究者通过原核注射过表达等实验,找到响应流体力的3个特异性增强子,确定其关键差异性原因。随后,研究者利用建立的KLF2报告小鼠,通过药物培养、磁流体等体内、体外力学干扰实验,进一步阐明KLF2的力学报告的准确性。
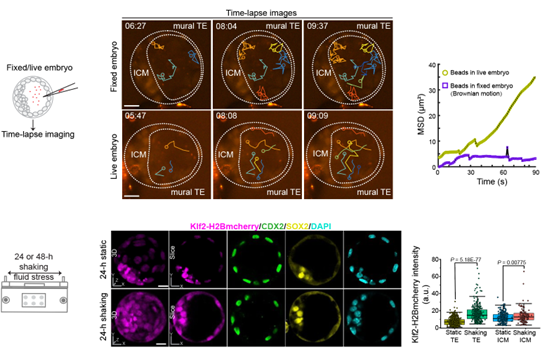
囊胚是早期胚胎发育的重要阶段,由滋养层、内细胞团和囊胚腔三部分结构组成。先前的研究已经指出,囊胚内的液体压力直接影响胚胎的大小,并对内细胞团和滋养层的命运决定起着关键作用【3】。研究者利用长时程体外流体力刺激及细胞移植等实验,确定流体力与细胞命运之间的联系,力的变化可由KLF2的荧光强度测定。
接下来,研究者将KLF2报告检测的发育中的流体力学动态变化,细胞命运和细胞谱系整合在一起绘制了全景力学细胞谱系图。研究者利用自建的高分辨率光片显微镜vLSFM,对Klf2-H2Bmcherry小鼠胚胎从E2.0到E3.5左右的发育过程进行了长时间活体成像全景谱系追踪,获取了多套小鼠胚胎着床前动态发育图谱。相较于研究者之前长时程动态追踪胚胎心室建成的工作【4,5】,研究者将传统的三角中空琼脂装载方法改为密封FEP管,以确保胚胎有足够的生长空间和培养液,同时实现内外隔离。通过活体成像技术的应用,研究者成功地探究了小鼠胚胎在力学报告模型的可视化系统中,在着床前阶段的细胞命运决定特性。研究结果表明,流体力越大,KLF2的表达越高,胚胎细胞倾向于分化成ICM;细胞感受到的流体力越小,KLF2的表达越低,细胞倾向于分化成TE。
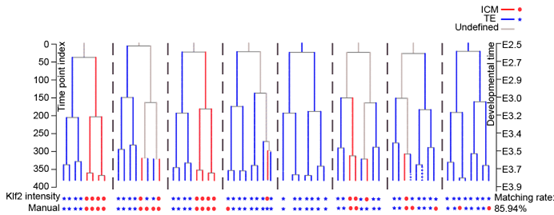
总之,该研究首次发现囊胚发育中存在流体力,并利用鉴定到的流体力学报告基因,开发了一套用于连续实时监测流体力和细胞命运的长时程活体成像系统,绘制了早期胚胎发育过程流体力学细胞谱系树。这项研究为机械生物学领域的研究提供了一种新的思路,利用遗传力学报告系统,未来或许可用于揭示肿瘤转移等过程中的机械力变化和命运决定。
北京大学未来技术学院博士生张幼东、李鑫、高姝和已毕业硕士研究生廖远辉为论文共同第一作者。北京大学-清华大学生命科学联合中心、北京大学未来技术学院何爱彬教授,以及实验室已毕业博士生(现吉林大学第一医院教授)岳晏竹教授为本文的共同通讯作者。北京大学工学院熊春阳教授和生命科学院杜鹏教授对研这项究提供了宝贵建议。该研究获得了科技部干细胞专项、国家自然科学基金委的和生命科学联合中心的支持。
【招聘北京大学事业编制副研究员和博士后】何爱彬团队招聘有发育生物学或血液疾病研究背景,对(1)实时成像研究器官发育和再生方向,或(2)单细胞表观多组学技术与疾病细胞起源机制研究感兴趣的研究人员(近2年或即将取得博士学位)。请参阅课题组网页http://aibinlab.org,并联系:ahe@pku.edu.cn.
原文链接:https://doi.org/10.1016/j.stem.2023.07.003
References:
1. Sasaki, H. (2015). Position- and polarity-dependent Hippo signaling regulates cell fates in preimplantation mouse embryos. Semin Cell Dev Biol 47-48 , 80-87. 10.1016/j.semcdb.2015.05.003.
2. Maitre, J.L., Turlier, H., Illukkumbura, R., Eismann, B., Niwayama, R., Nedelec, F., and Hiiragi, T. (2016). Asymmetric division of contractile domains couples cell positioning and fate specification. Nature 536 , 344-348. 10.1038/nature18958.
3. Chan, C.J., Costanzo, M., Ruiz-Herrero, T., Monke, G., Petrie, R.J., Bergert, M., Diz-Munoz, A., Mahadevan, L., and Hiiragi, T. (2019). Hydraulic control of mammalian embryo size and cell fate. Nature 571 , 112-116. 10.1038/s41586-019-1309-x.
4. Yue, Y., Zong, W., Li, X., Li, J., Zhang, Y., Wu, R., Liu, Y., Cui, J., Wang, Q., Bian, Y., et al. (2020). Long-term, in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nat Cell Biol 22 , 332-340. 10.1038/s41556-020-0475-2.
5. Li, X., Yue, Y., Zhang, Y., Liao, Y., Wang, Q., Bian, Y., Na, J., and He, A. (2022). Continuous live imaging reveals a subtle pathological alteration with cell behaviors in congenital heart malformation. Fundamental Research 2 , 14-22.
