2025年12月06日,北京大学未来技术学院李长辉课题组、南京大学智能科学与技术学院姚遥课题组及韩国浦项科技大学Chulhong Kim课题组合作团队在《Nature Communications》发表题为 “SlingBAG: point cloud-based iterative algorithm for large-scale 3D photoacoustic imaging” 的最新研究成果。大视场三维(3D)光声成像(PAI)在科研和临床应用中日益重要,但受限于系统成本和复杂性,往往只能使用稀疏分布的传感器阵列,这导致传统重建算法会产生严重伪影。而现有的迭代重建(IR)算法虽然能提升图像质量,但面临着难以承受的计算内存和时间消耗,严重阻碍光声3D成像的应用。该团队提出的SlingBAG算法,通过创新性的引入“点云”概念取代传统的空间体素网格,不仅将内存消耗降低了几个数量级,还实现了更高速的高质量的3D光声图像重建。

长期以来,光声成像(PAI)因结合了超声检测和光学吸收对比度的优势,成为唯一能以优越的空间分辨率在活体组织深处进行成像的非侵入性光学方法。然而,为了满足实时大规模3D PAI的空间奈奎斯特采样要求,通常需要多达万数的超声换能器阵列及同等数量的数据采集通道,这在制造难度和成本上都是巨大的挑战。因此,现实中的系统往往采用稀疏分布的传感器,导致传统反投影方法重建的图像信噪比低且伪影严重。而能有效抑制伪影的基于空间网格架构的迭代算法对内存需求远远超出普通消费级计算资源,难以实际应用。针对这一瓶颈,研究团队开发了基于点云的新型迭代算法。
1. 突破传统网格限制:基于点云的自适应生长算法(SlingBAG)
研究团队提出了一种全新的范式,摒弃了传统的均匀体素网格表示法,转而采用点云形式存储光声源信息。如图1所示,SlingBAG(Sliding Gaussian Ball Adaptive Growth,滑动高斯球自适应生长)算法将3D光声场景建模为一系列高斯分布的球形源。在迭代过程中,算法不仅持续优化每个高斯源的峰值强度(初始压力)、标准差(大小)和均值(位置),还引入了自适应密度优化机制:高斯源会根据自身强度和标准差大小进行自适应的“销毁”、“分裂”和“复制”。
团队还基于光声球源在非粘性均匀介质中波动方程的解析解,构建了“可微快速辐射器”模型,极大地提高了正向问题的求解速度。通过最小化预测信号与实际光声信号之间的差异,迭代优化点云,最终通过物理着色器将点云转换为体素网格,完成3D成像重建。这种方法不仅大幅降低了内存需求,还显著提升了计算效率。
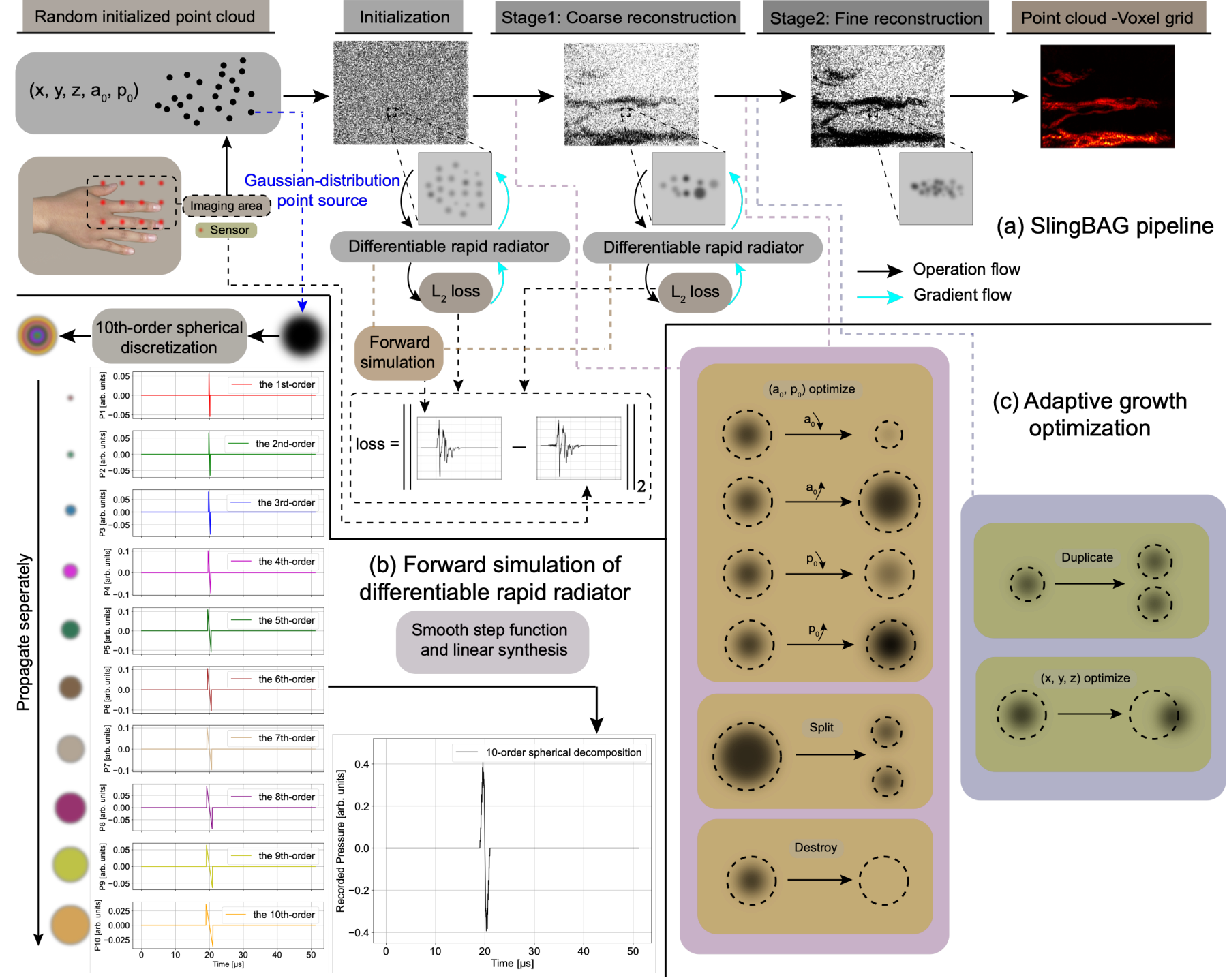
图1. SlingBAG点云迭代重建算法流程。
2. 稀疏传感器阵列实现高保真大尺度三维重建
研究团队首先利用模拟的手部血管数据检验了SlingBAG算法的高质量重建能力。如图2所示,在极度稀疏的传感器配置下(如49个、196个传感器),传统的通用反投影(UBP)算法产生的图像具有严重伪影,血管几乎无法辨认,而传统的基于模型的点探测器(MB-PD)算法虽然有所改善,但仍存在明显模糊。相比之下,SlingBAG算法表现出卓越的重建能力,即便仅使用49个传感器也能重建出明显的原始血管轮廓。当传感器数量增加到196个时,SlingBAG已能实现大部分血管精细结构高质量重建,而其他算法仍存在严重的伪影。
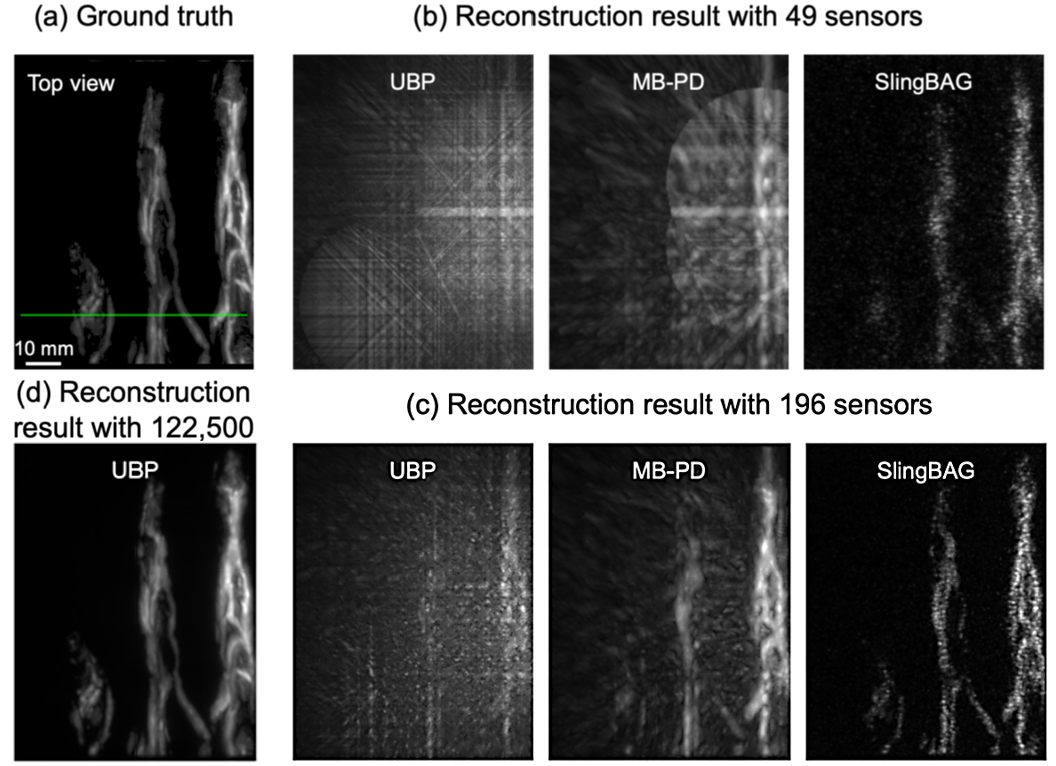
图2. 极稀疏平面阵列下SlingBAG实现高质量 PAI重建。
为了进一步评估临床及科研应用价值,研究团队利用SlingBAG对半球形超声换能器阵列对活体小鼠大脑、大鼠肾脏和肝脏成像的真实数据进行了重建。结果显示,SlingBAG算法重建的图像伪影显著减少,血管细节更加清晰可见,对比度显著优于传统方法。例如在小鼠肝脏重建(图3)中,SlingBAG的对比噪声比(CNR)达到42.01,远高于UBP(30.62)和MB-PD(37.28)。
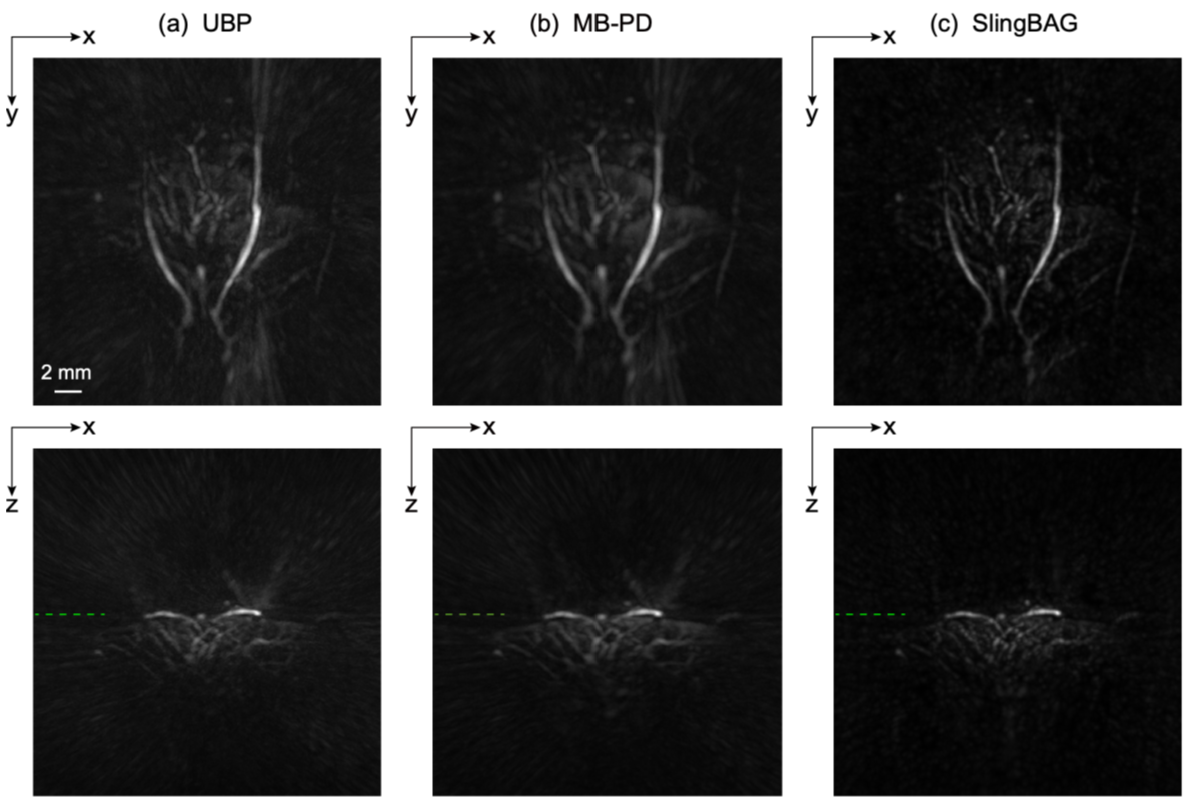
图3. 大鼠肝脏的3D PAI重建结果对比。
3. 计算资源消耗上有巨大优势
尤为重要的是,SlingBAG在计算资源消耗上展现了巨大优势。在手部血管成像模拟中,SlingBAG仅需3.56 GB的GPU内存;而在活体动物成像实验中,仅需2.99 GB。相比之下,对这两种情形下传统的迭代重建方法(如k-Wave)在相同条件下的理论内存需求高达19.32 GB和85.87 GB。相比之下,SlingBAG能够让普通的消费级GPU也能承担大规模3D光声成像的计算任务,极大地降低了硬件门槛。
总的来说,SlingBAG算法通过点云表示和自适应优化策略,为大规模3D光声成像中长期存在的计算资源瓶颈和稀疏采样伪影问题提供了极具潜力的解决方向。该方法不仅具备卓越的成像质量和极低的计算资源需求,还适用于平面、球面等多种阵列配置,有望推动实时全身小动物成像、外周血管及肿瘤3D成像技术的广泛应用。
北京大学未来技术学院的博士研究生李爽、王一冰,以及南京大学智能科学与技术学院的博士研究生高建为本文的共同第一作者。北京大学李长辉教授、南京大学姚遥教授为本文的共同通讯作者。韩国浦项科技大学的Chulhong Kim教授、Seongwook Choi博士以及北京大学未来技术学院的博士生张瑜、陈倩都为研究做出了卓越贡献。本工作得到了国家重点研发计划、国家自然科学基金等项目的资助,同时,本研究还得到了北京大学国家生物医学成像中心生物医学计算平台的支持。
