2024年2月27日,北京大学未来技术学院赵扬课题组在Cell杂志子刊、美国基因与细胞治疗学会(ASGCT)会刊Molecular Therapy上在线发表了题为Osr1-mediated mesothelial transition of liver mesenchymal cells exacerbates fibrotic liver damage的研究论文1。该论文首次在单细胞水平上详细描述了肝脏慢性损伤诱导产生的肝星状细胞(Hepatic stellate cell,HSC)向间皮细胞(mesothelial cell, MC)表型的转化过程,该过程被命名为MMesoT(mesenchymal to mesothelial transition, MMesoT),并通过研究其中间态细胞(Damage-associated Intermediates between HSC and MC, DIHMs),揭示了DIHMs诱导的关键调节因子Osr1(odd-skipped related 1)。通过敲低或条件性敲除Osr1或者利用双重组酶系统介导DIHM细胞的清除可以减缓肝脏纤维化的进程,有望为临床上治疗慢性肝病提供新靶点和新机制(图1)。
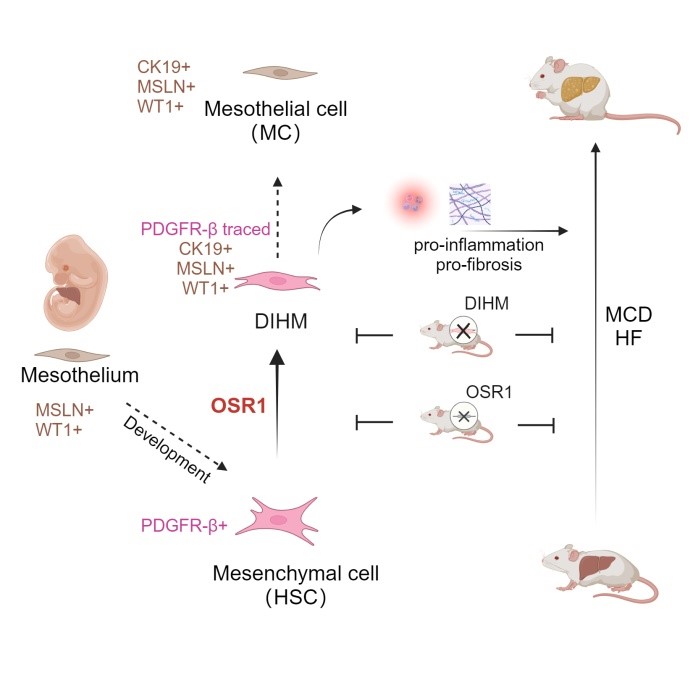
图1. 肝内损伤诱导产生MMesoT过程及其调控机制示意图
慢性肝病是威胁人类健康甚至是生命的一类重要疾病,多数慢性肝病都会发生肝脏纤维化,它的严重程度也是临床上评估生存率的重要指标2。多项研究表明,过渡分泌胶原的肌成纤维细胞主要来自于微环境中被激活的肝星状细胞(hepatic stellate cells, HSCs),这也是肝纤维化干预所针对的主要细胞类群3-5。然而,病理状态下肌成纤维细胞的性质及其动态变化规律并未详细阐述,到目前为止仍然没有一款针对性治疗肝纤维化的上市药物应用于临床6。因此,发现肝纤维化过程的新靶点及探索新的干预方式对于治疗以肝纤维化为首要特征的慢性肝病十分重要。
在这项研究中,论文作者首先通过对Col1a2CreERT2;R26RtdTomato谱系示踪小鼠标记并富集肝间质细胞进行单细胞转录谱测序,并结合生物信息学分析其异质性及动态变化过程,之后使用谱系示踪小鼠(PdgfrbCreERT2;R26RtdTomato)进行生物实验验证,揭示了损伤诱导肝间质细胞获得了间皮样细胞(mesothelial cells, MCs)性质的亚群,DIHM细胞(damage-associated intermediates between HSCs and MCs, DIHMs)(图2 A-C)。此外,研究者还构建了2A-DTR;PdgfrbCreERT2;Krt19Dre对DIHM细胞进行清除,阐明了DIHMs在肝脏损伤过程中的促纤维化作用:通过注射白喉毒素清除DIHMs后,肝脏纤维化面积明显减少,肝脏功能得到改善,证实DIHMs具有加重肝脏纤维化损伤的作用(图2 D)。
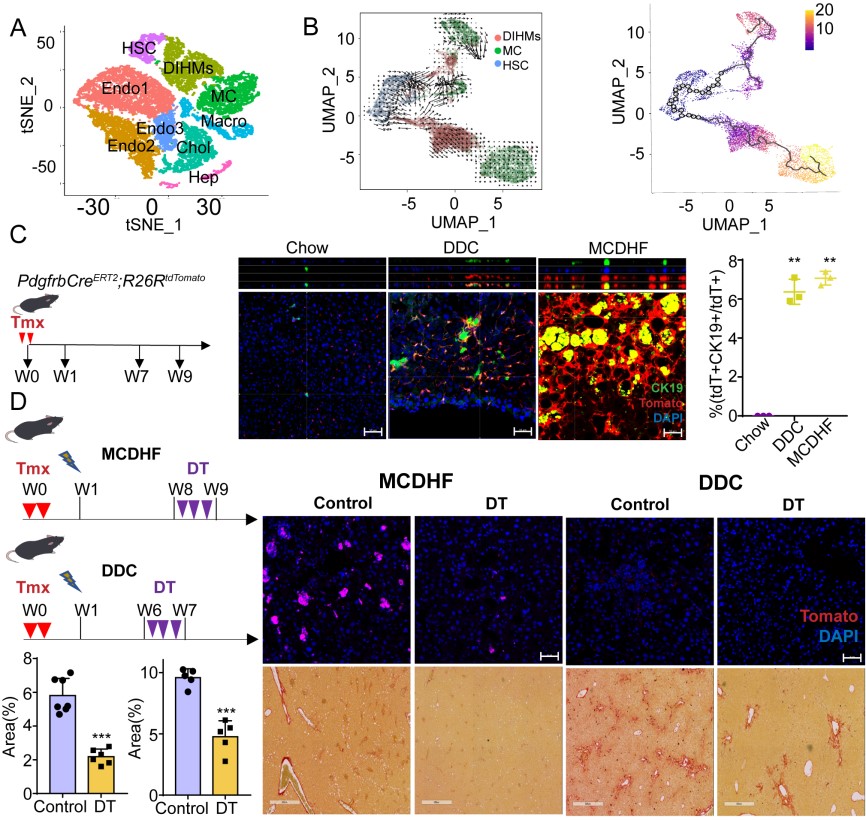
图2. 肝脏损伤诱导产生的DIHMs影响肝脏纤维化
在调控细胞命运转变的机制上,论文作者通过生物信息学分析揭示了调控肝内MMesoT过程产生DIHM细胞的转录因子调控网络及其关键调节因子Osr1。通过体内外实验筛选并鉴定发现,抑制Osr1的表达能够逆转肝脏损伤诱导的MMesoT过程,并缓解肝脏纤维化损伤(图3)。
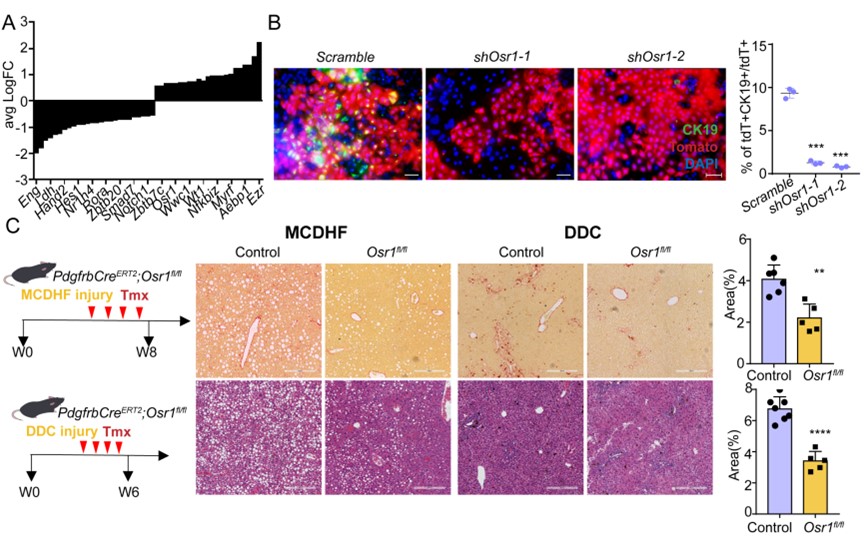
图3.Osr1介导MMesoT过程及DIHMs的产生从而影响肝脏纤维化
北京大学前沿交叉学科研究院生命科学联合中心2018级博士研究生年欣欣(已毕业)是该论文的第一作者。北京大学未来技术学院、生命科学联合中心赵扬研究员指导了此项工作,是该成果的通讯作者。中国科学院分子细胞科学卓越创新中心周斌研究员为本项目提供了独特的双重组酶谱系追踪系统。北京大学人民医院高杰教授给本项目提供了支持帮助。
该工作得到了国家重点研发计划(2018YFA0800504)和国家自然科学基金(32170743, 31922020和31771645)的资金支持。
1. Nian, X., Lin, P., Bai, Y., Yu, D., Yang, X., Zhou, B., Gao, J., Zhao, Y. (2024). Osr1-mediated mesothelial transition of liver mesenchymal cells exacerbates fibrotic liver damage. Mol Ther.in press, https://doi.org/10.1016/j.ymthe.2024.02.024
2. Asrani, S.K., Devarbhavi, H., Eaton, J., Kamath, P.S. (2019). Burden of liver diseases in the world. J Hepatol. 70, 151-171.
3. Iwaisako, K., Jiang, C., Zhang, M., Cong, M., Moore-Morris, T.J., Park, T.J., Liu, X., Xu, J., Wang, P., Paik, Y.H., et al. (2014). Origin of myofibroblasts in the fibrotic liver in mice. Proc Natl Acad Sci U S A. 111, E3297-3305.
4. Kisseleva, T., Cong, M., Paik, Y., Scholten, D., Jiang, C., Benner, C., Iwaisako, K., Moore-Morris, T., Scott, B., Tsukamoto, H., et al. (2012). Myofibroblasts revert to an inactive phenotype during regression of liver fibrosis. Proc Natl Acad Sci U S A. 109, 9448-9453.
5. Rezvani, M., Español-Suñer, R., Malato, Y., Dumont, L., Grimm, A.A., Kienle, E., Bindman, J.G., Wiedtke, E., Hsu, B.Y., Naqvi, S.J., et al. (2016). InVivo Hepatic Reprogramming of Myofibroblasts with AAV Vectors as a Therapeutic Strategy for Liver Fibrosis. Cell Stem Cell. 18, 809-816.
6. Sumida, Y., Yoneda, M. (2018). Current and future pharmacological therapies for NAFLD/NASH. J Gastroenterol. 53, 362-376.
