钠-葡萄糖共转运蛋白2(SGLT2)是维持人体血糖稳态的关键膜蛋白,主要在肾脏近曲小管S1段表达,负责约90%的葡萄糖重吸收功能1,2。SGLT2依赖钠离子浓度梯度,将葡萄糖从肾小管腔逆浓度转运回血液,防止其随尿液流失1,2。药理性抑制SGLT2可促进尿糖排泄、降低血糖,因此广泛用于II型糖尿病治疗3,4。
此前,北京大学未来技术学院陈雷课题组报导了人源SGLT2-MAP17异源二聚体与降糖药恩格列净(Empagliflozin)复合物的结构5,发现恩格列净将SGLT2锁定在外向开放构象。随后SGLT2与TA1887、索格列净(Sotagliflozin)、达格列净(Dapagliflozin)和卡格列净(Canagliflozin)等抑制剂的复合物结构也得到了解析6,7。陈雷课题组还报道了SGLT2-MAP17复合物的双向关闭构象和内向开放构象的结构,揭示了葡萄糖转运过程中的SGLT2的构象变化8。然而受限于这些研究的分辨率,关于SGLT2识别底物的精确机制,SGLT2的构象变化如何促进底物向胞内释放,以及发挥关键作用的氨基酸如何进行构象变化等问题仍未完全阐明。
2025年8月4日,陈雷课题组在Nature Communications杂志发表题为“Mechanism of substrate recognition and release of human SGLT2”的研究论文(https://www.nature.com/articles/s41467-025-62421-6),报道了SGLT2-MAP17的一系列高分辨率冷冻电镜结构(最高平均分辨率达2.47 Å),包括底物结合的关闭构象、底物结合的内向开放构象,以及在钠离子或钾离子存在环境下未结合底物的内向开放构象,系统揭示了转运过程中底物的识别与释放和门控维持机制。
在SGLT2底物结合的关闭构象中,作者们发现葡萄糖类似物4FDG13可与底物结合位点的关键氨基酸残基(如H80、N75、E99、K321、W291)及周围水分子形成复杂的氢键网络。此外,F98与W291两个芳香族残基位于底物两侧,其疏水相互作用有助于稳定底物结合。钠离子结合在由I76、A73、A389、S392与S393组成的结合位点中,为驱动葡萄糖逆浓度梯度转运提供能量基础(图1)。

图1 SGLT2在关闭构象中的钠离子与葡萄糖结合位点结构特征
与已报道的外向开放态结构相比,作者们发现随着底物进入结合位点,TM0、TM4、TM9和TM10等螺旋向中央聚拢,导致外门关闭。其中,多对极性相互作用参与维持外门稳定,包括362-G450、T87-Q451、D454-Y526、N363-G450和D25-R379,突变实验进一步验证了这些相互作用对转运功能的必要性(图2)。
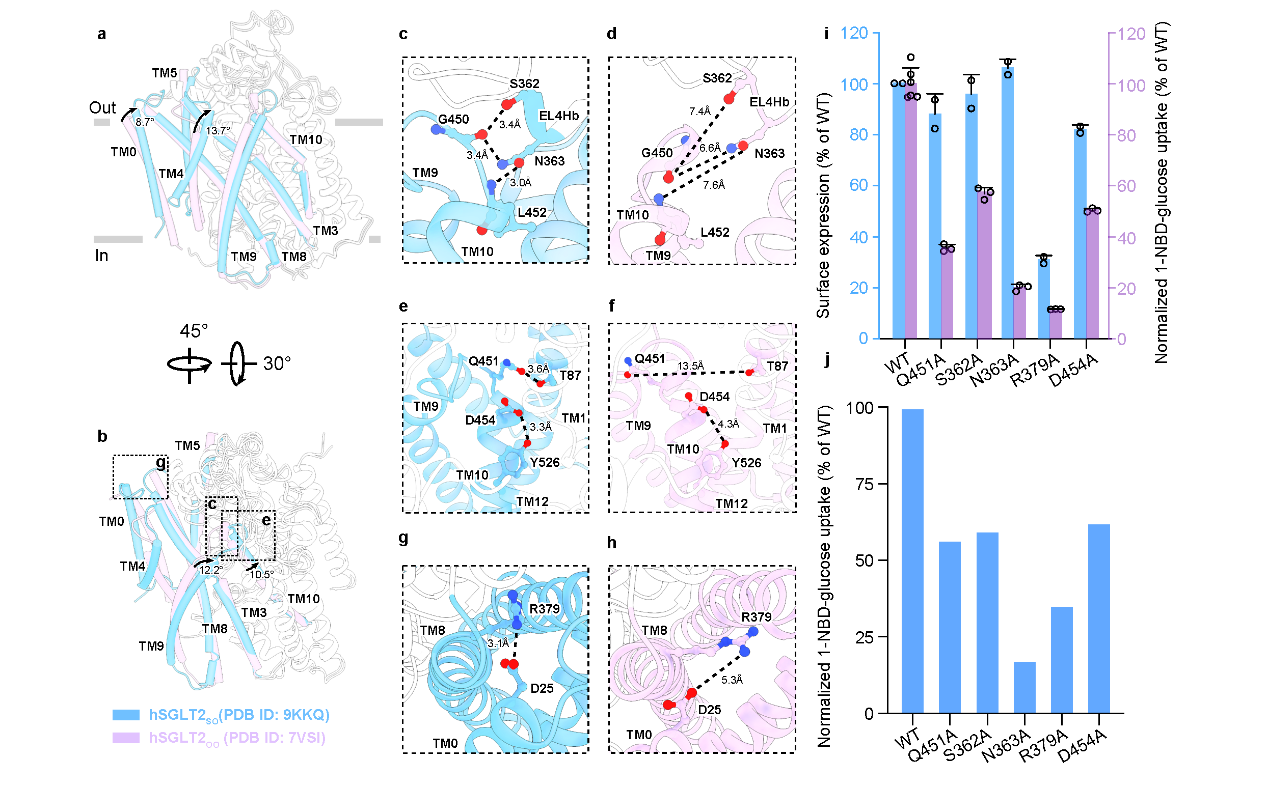
图2 SGLT2从外向开放构象到底物结合的关闭构象的结构变化
在底物结合的内向开放构象中,作者们发现钠离子结合位点被破坏,表明钠离子优先释放。同时,在底物结合位点,F98、Y290、N75等关键残基位置发生明显外移,底物稳定性下降,提示该状态代表底物释放前的中间态(图3)。

图3 SGLT2在内向开放构象下的钠离子结合位点与葡萄糖结合位点
作者们将底物结合的关闭构象与内向开放构象相比,发现构象变化主要集中在TM5、TM8和TM9等螺旋,其共同作用导致内门打开,其中,Q299-T403、R300-S396和T124-D408对于内门稳定性的维持其关键作用,T403A、S396A等突变显著削弱了转运功能。
为进一步揭示底物释放过程中的结构变化,作者们分别解析了SGLT2在钠离子或钾离子存在条件下未结合底物的内向开放状态的结构。相比于底物结合的内向开放构象,在钠离子存在条件下,作者发现未结合底物的SGLT2的TM1a、TM5等发生了构象变化。关键底物结合残基N75的侧链偏移3.4 Å,破坏了底物结合位点;Na2位点的I76也发生位置上移,结合位点进一步被破坏。SGLT2将葡萄糖和钠释放至胞质中,而胞质环境中钠离子浓度较低,钾离子浓度较高。钾离子存在条件下,结构柔性进一步增强。SGLT2的电子云密度在TM1a、TM6b及551-572位氨基酸的胞内loop区域出现明显模糊甚至完全缺失,提示其高度动态。与钠离子存在条件下对比,胞内区域的TM2、TM6a和TM7进一步向外张开,构象开放程度更高。
综上所述,作者们通过解析SGLT2在多种构象状态下的高分辨率结构,绘制了底物识别过程中精细的氢键网络,识别出多对极性相互作用对于稳定特定构象的重要作用,深化了我们对SGLT2在葡萄糖转运过程中结构可塑性与动态调控机制的理解。
北京大学未来技术学院分子医学所博士研究生崔文浩和北京大学前沿交叉学科研究院、北大-清华生命科学联合中心博士研究生孙泽健为本论文的共同第一作者,陈雷研究员为论文的通讯作者。该研究还得到陈雷课题组的博士后康云路,博士生徐家璇、刘啸宇的大力协助。该工作冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台完成,得到了李雪梅、郭振玺、秦昌东和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。该课题得到国家自然科学基金以及生命科学联合中心等经费支持。
参考文献
1 Wells, R. G., Pajor, A. M., Kanai, Y., Turk, E., Wright, E. M. & Hediger, M. A. Cloning of a human kidney cDNA with similarity to the sodium-glucose cotransporter. Am. J. Physiol. 263, F459-465 (1992). https://doi.org:10.1152/ajprenal.1992.263.3.F459
2 Kanai, Y., Lee, W. S., You, G., Brown, D. & Hediger, M. A. The human kidney low affinity Na+/glucose cotransporter SGLT2. Delineation of the major renal reabsorptive mechanism for D-glucose. J. Clin. Invest. 93, 397-404 (1994). https://doi.org:10.1172/JCI116972
3 Vallon, V. The mechanisms and therapeutic potential of SGLT2 inhibitors in diabetes mellitus. Annu. Rev. Med. 66, 255-270 (2015). https://doi.org:10.1146/annurev-med-051013-110046
4 Dharia, A., Khan, A., Sridhar, V. S. & Cherney, D. Z. I. SGLT2 Inhibitors: The Sweet Success for Kidneys. Annu. Rev. Med. 74, 369-384 (2023). https://doi.org:10.1146/annurev-med-042921-102135
5 Niu, Y. et al. Structural basis of inhibition of the human SGLT2-MAP17 glucose transporter. Nature 601, 280-284 (2021). https://doi.org:10.1038/s41586-021-04212-9
6 Hiraizumi, M. et al. Transport and inhibition mechanism of the human SGLT2-MAP17 glucose transporter. Nat. Struct. Mol. Biol. (2023). https://doi.org:10.1038/s41594-023-01134-0
7 Sun, Z., Cui, W. & Chen, L. Structures reveal how SGLT inhibitors work. Trends Pharmacol. Sci. 45, 760-763 (2024). https://doi.org:10.1016/j.tips.2024.05.009
8 Cui, W., Niu, Y., Sun, Z., Liu, R. & Chen, L. Structures of human SGLT in the occluded state reveal conformational changes during sugar transport. Nat Commun 14, 2920 (2023). https://doi.org:10.1038/s41467-023-38720-1
