News
对活体生物样本进行长时程、高分辨率的光学三维成像,对于探索介观-微观水平的生理功能和系统行为至关重要。由于生物组织对成像光子的高散射特性,高分辨率的光学成像被限制在样本表层。多光子显微成像技术因其更长的激发波长和非线性激发特性,提供了更大的成像穿透深度,广泛应用于高散射生物样本的深层成像应用。然而,多光子显微镜的深层成像通常以更高激发功率或更长曝光时间为代价,对生物样本造成光损伤并限制了长时程成像应用。
为了实现对高散射厚生物样本的长时程、大体积、高分辨率的三维成像观测,北京大学程和平/王爱民团队开发了双侧双光子显微镜(DualObjective Two-photon Microscope, Duo-2P)。通过简洁而有效的显微镜构型设计,由双侧双光子激发和荧光收集,将极限成像深度扩展到两倍左右。对厚度约五个散射长度的生物样本,Duo-2P仅需传统双光子显微镜1/10的激发能量输入即可完成逐层光栅扫描的三维成像,极大的降低了活体成像的光损伤,并获得最高1.4倍的信噪比增益。此外,Duo-2P还成倍增加了成像体积。该成果以“Dual-objective two-photon microscope for volumetric imaging of dense scattering biological samples by bidirectional excitation and collection”为题,在线发表于Photonics Research。
该系统已成功用于研究团队有关哺乳动物生物钟时间编码的研究工作,在获取生物钟运行数据、解析视交叉上核的时间编码机制中发挥了重要的作用。(Wang, Z., Yu, J., Zhai, M. et al.Cell Res. (2024))
对生物样本的长时程、高分辨率的三维成像,在生理和病理研究中至关重要。然而,生物样品的高散射特性从根本上限制了成像深度,同时降低了成像质量并限制了成像持续时间。尽管多光子显微镜因其更长的激发波长及非线性激发特性,被广泛应用于亚细胞分辨率的厚散射样品成像,但在深层成像时,多光子激发引起的光漂白和光损伤限制了长期的成像研究。
程和平/王爱民团队针对组织切片、类器官、发育胚胎和小生物体等样本体积小、致密且高度散射的特点,提出了一种具备双物镜的双侧双光子显微镜构型(图1,图2)。在该构型下,正置/倒置共振扫描双光子显微镜对称设置于样本两侧并分别负责对样品一半体积进行成像,由激光路径切换及物镜轴向步进运动完成交替的逐层光栅扫描成像,最终由体积图像合成获得样本的完整三维图像数据。
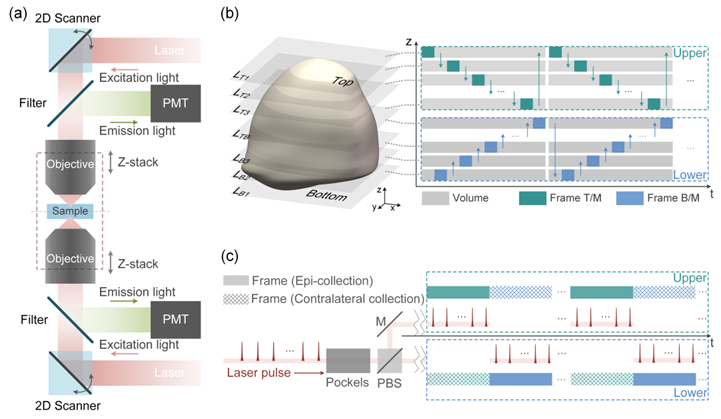
图1. (a) Duo-2P原理示意图。(b) Duo-2P的体积成像时序,上下侧显微镜交替执行光栅扫描与物镜步进,并由来自两个显微镜的Z堆栈图像结合得到样本完整三维图像。(c)Duo-2P的激发与荧光收集时序,上下侧显微镜逐帧分时激发并同时对荧光信号进行收集。

图2.Duo-2P成像系统
通过简洁的双光子显微镜构型创新,Duo-2P将受限于信背比的极限成像深度扩展到两倍以上。同时,以样品厚度为散射长度五倍为例,与传统落射双光子显微镜相比,Duo-2P将总激发能量降低一个数量级。此外,对侧额外的荧光收集提高了图像质量,尤其是在样品深层,图像信噪比最多提高1.4倍。双物镜构型同时增加了受限于物镜工作距离的成像体积,特别在低散射厚样本的体积成像中,实现厚度两倍于物镜工作距离的生物样本的完整体积成像。研究者分别由模拟计算及验证实验分析了Duo-2P在厚散射样本中的成像性能(图3)。结合与Duo-2P相匹配的双侧成像腔室,对高散射、密集标记的小鼠视交叉上核中数千颗神经元进行连续4小时的钙信号记录。
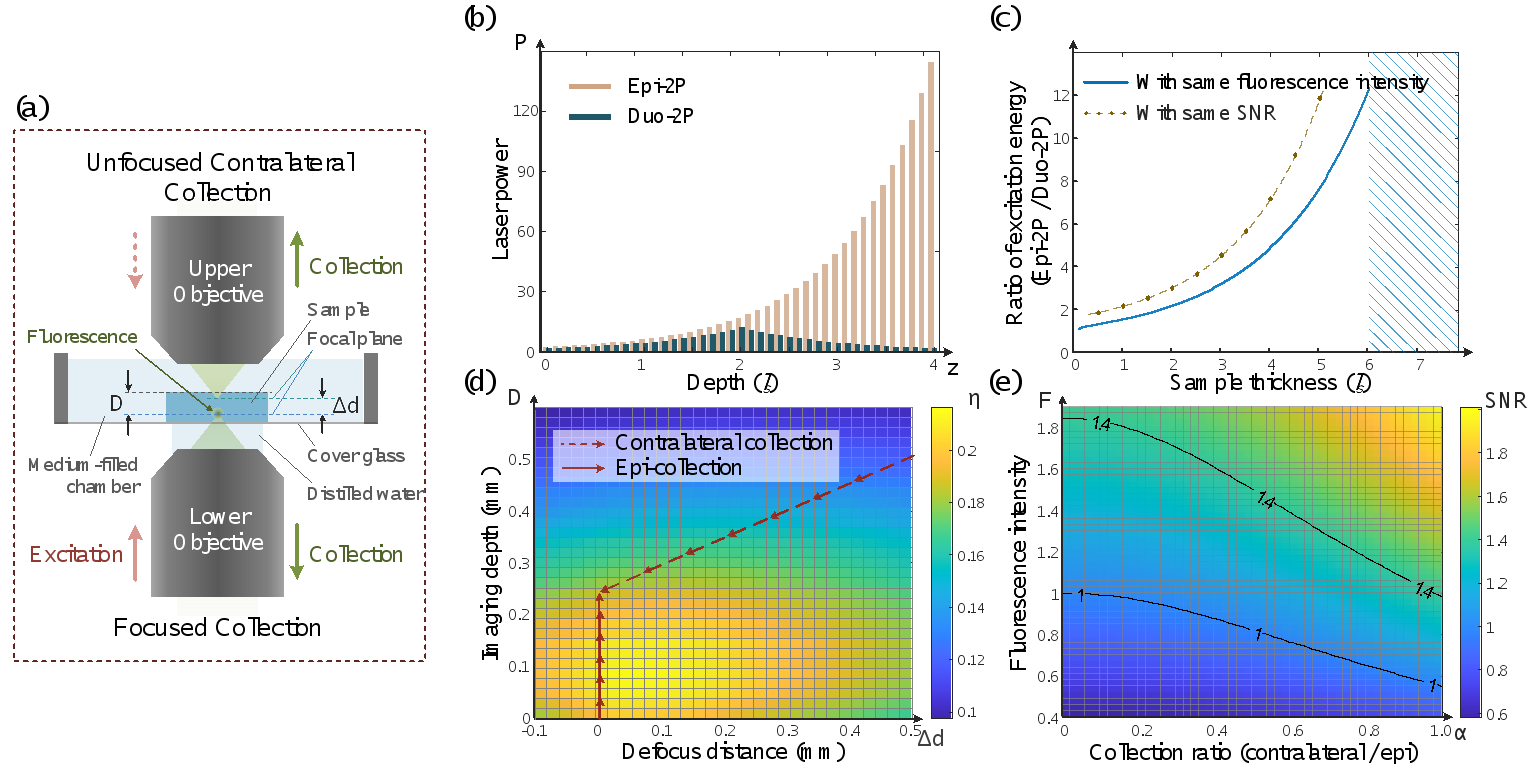
图3. Duo-2P中双侧激发与荧光收集的模拟计算。(a) 图1(a)中虚线框内成像腔室放大示意图。(b) Duo-2P与传统双光子显微镜在不同成像深度的激发光功率比较。(c) 在不同样本厚度的体积成像时,Duo-2P与传统双光子的输入能量之比。(d) 成像深度(D)和离焦距离(Δd)对荧光收集效率(η)的影响。(e)与对侧荧光收集效率和荧光强度相关的信噪比增益计算结果。
Duo-2P在研究团队对哺乳动物生物钟时间编码的研究工作中,完成对近万颗神经元的钙活动的跨昼夜成像记录,为解析视交叉上核的时间编码机制提供完整的成像数据支持。研究团队也期待该技术在脑科学、发育生物学及类器官等生物学研究领域的广泛应用。
北京大学未来技术学院博士生翟慕岳为论文第一作者,北京大学未来技术学院程和平教授与北京大学电子学院王爱民副教授为论文通讯作者。该成果得到国家自然科学基金与医学科学创新基金的支持。
