2021年10月12日下午,受北京大学未来技术学院分子医学研究所汪阳明教授邀请,清华大学药学院饶燏教授在未来技术学院报告厅带来了一场题目为“PROTAC小分子靶向蛋白降解技术及其应用”的精彩报告。
背景介绍:
1997年罗氏公司(Roche)开发了第一个靶向抗癌药物Rituximab抗体药(商品名:美罗华),该单抗药物通过靶向CD20杀死肿瘤细胞,用于治疗非霍奇金淋巴瘤。2001年由瑞士诺华公司(Novartis)开发的甲磺酸伊马替尼(商品名:格列卫)被批准上市,该小分子与ATP等底物竞争性结合各种酪氨酸激酶如ABL受体、C-Kit受体以及血小板衍化生长因子(PDGF)受体等,可以用于慢性粒细胞性白血病(CML)的治疗,该药物正式将我们带入小分子靶向治疗的时代。但目前许多传统小分子采用竞争性结合发挥抑制作用,因此人体内有大约85-90%的蛋白为不可成药靶点,特别是有70%的激酶家族都是难成药的靶点。所以PROTAC(Proteolysis-Targeting Chimera)这种小分子药物治疗策略就应运而生,它由三部分组成:E3连接酶配体、连接体、靶蛋白配体,通过这种复合体将E3连接酶与靶标蛋白拉近,利用体内泛素-蛋白酶体蛋白降解途径特异性降解靶蛋白。
不同于传统小分子药物的占有性驱动,PROTAC技术无需竞争性结合,有望突破不可成药和耐药性的难题。且PROTAC分子发挥作用需要经过结合加识别两步(图1),因此选择性显著优于传统抑制剂。与传统治疗技术-小分子抑制剂、基于核酸的策略相比,PROTAC还有其他优势:催化优势、化学敲降和可逆。因此PROTAC是可以与现有技术互补的突破性技术。本次讲座,饶燏教授就PROTAC技术的优劣、发展及挑战进行了介绍。
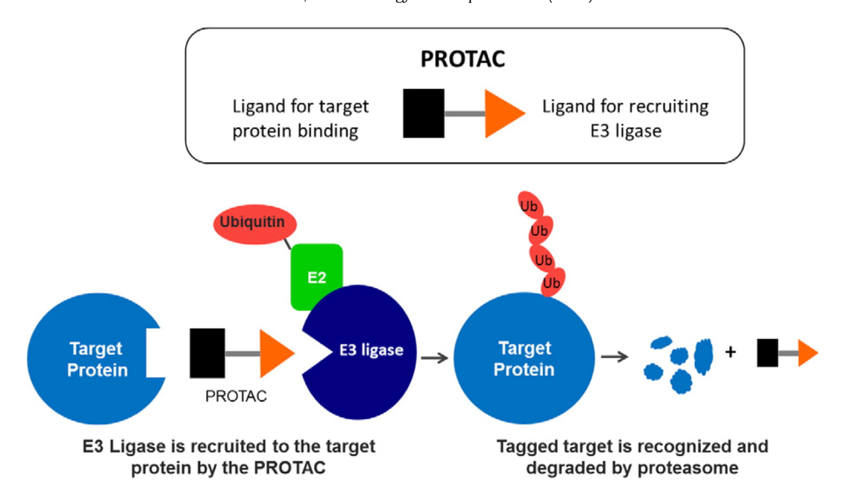
图1 PROTAC技术降解蛋白的机制(Neklesa et al., 2017)
报告回顾:
PROTAC的发展历程
2001年,Crews等科学家首次提出PROTAC(Protein-Targeting Chimeric Molecule)的概念,即利用体内蛋白酶体降低靶标蛋白水平而非抑制蛋白功能。2008年同样是Crews团队合成了首个小分子PROTAC(靶向MDM2,一种降解抑癌基因P53蛋白的E3连接酶)。 2010年Handa等研究者们发现臭名卓著的沙利度胺的作用靶点是CRBN E3连接酶,随后领域内开始了基于沙利度胺类小分子的PROTAC技术开发。饶燏教授介绍这个领域一直以来发展较慢,其中一个重要原因就是E3连接酶配体的缺乏。直到2019年FDA批准PROTAC首款药物进入临床,PROTAC技术才进入快速发展期,此类蛋白降解药物在同年被自然杂志专题评为“下一个重磅炸弹疗法”。目前至少有10-20款药物已经或将进入临床,成为新药研发最火热的技术之一(图 2)。
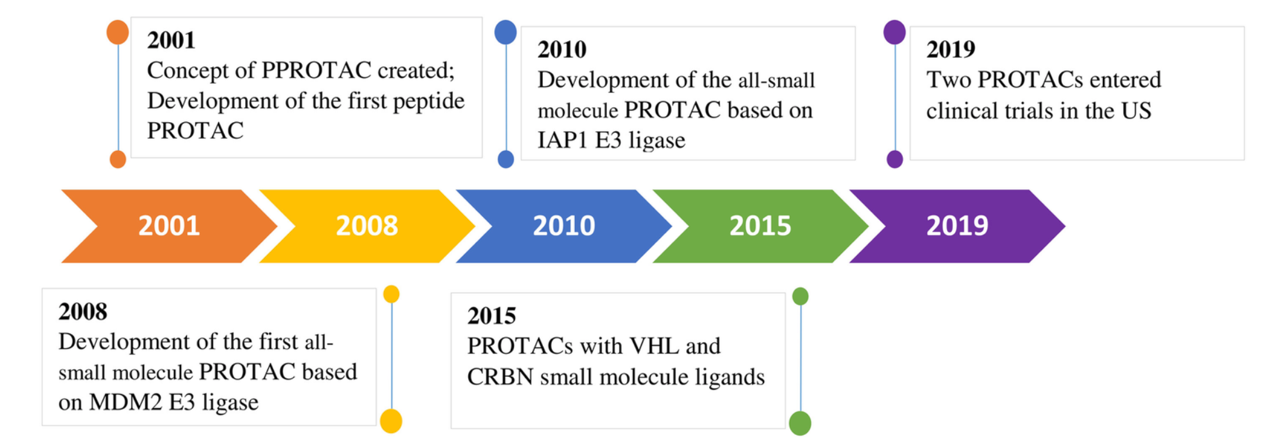
图2 PROTAC技术发展的里程碑(Li and Song, 2020)
饶燏教授实验室在2015年开始PROTAC技术平台的建设,聚焦于发展蛋白降解技术及应用,开发快速高效的PROTAC分子。在2018年克服临床耐药突变,研发了全球首个BTK高效降解剂;2019年与北京大学的研究人员合作构建了恒河猴PROTACs系统性敲除模型,进行了大动物PROTAC药效的概念性验证;2021年首次开发了CDK2选择性降解剂与双机制降解剂。
代表性工作一:克服依鲁替尼耐药非霍奇金淋巴瘤
酪氨酸蛋白激酶BTK对B淋巴细胞的发育分化至关重要,负责汇集多种信号蛋白,是检测病原体TLR途径的组成部分,与多种免疫、肿瘤疾病相关,是药物开发的热门靶点。Ibrutinib依鲁替尼是第一个BTK抑制剂,迄今已获FDA批准在7个适应症上使用。依鲁替尼可以与BTK活性位点中481Cys共价交联,在体内外实验中均显示出抗癌活性,但有报道病人BTK蛋白会发生C481S突变而产生耐药性。为了克服了淋巴瘤BTK蛋白点突变耐药性,饶燏教授课题组以依鲁替尼为基础开发了高效BTK降解剂P13I (图3),该分子对于WT与C481S的降解效率都非常高,对BTK突变型蛋白包容性很强。且由于PROTAC的高选择性,有效降低了依鲁替尼对同一个激酶家族的脱靶效应。同时该药物溶解性很好,经体内实验证明可以有效的在体内进行靶向降解。

图3 P13I降解耐药性C481S突变BTK蛋白(Sun et al., 2018)
代表性工作二:首个CDK2选择性降解小分子
周期蛋白依赖性激酶CDK家族调控细胞周期的正常进行,在肿瘤发生、细胞分化等过程中发挥重要功能。其中CDK4/6已经成为抗癌的新兴药物靶点,CDK2也有研究证明其敲降可诱导AML细胞产生分化,可能成为分化治疗的药物靶点。然而一直以来,CDK家族成药十分困难,缘由传统小分子经常会发生多靶点抑制,难以实现高效、高选择性的调控。因此,饶燏教授希望挑战此一难题,设计选择性降解CDK2的PROTAC小分子以诱导AML细胞分化。不同于杀伤细胞的小分子,分化治疗的靶点相对安全,可以与其他药物联用。经过迭代设计与结构优化,饶燏团队最终基于筛选出的配体成功开发出CDK2选择性降解剂CPS2,具有很好的选择性和很高的活性。CPS2可以在nM(10-9 摩尔每升)浓度下实现敲降,在6小时左右即可将CDK2蛋白降解完全,能够阻滞肿瘤细胞增殖(图4)。并且对其它CDK蛋白没有显著影响,可以实现AML高效且低毒的分化治疗。
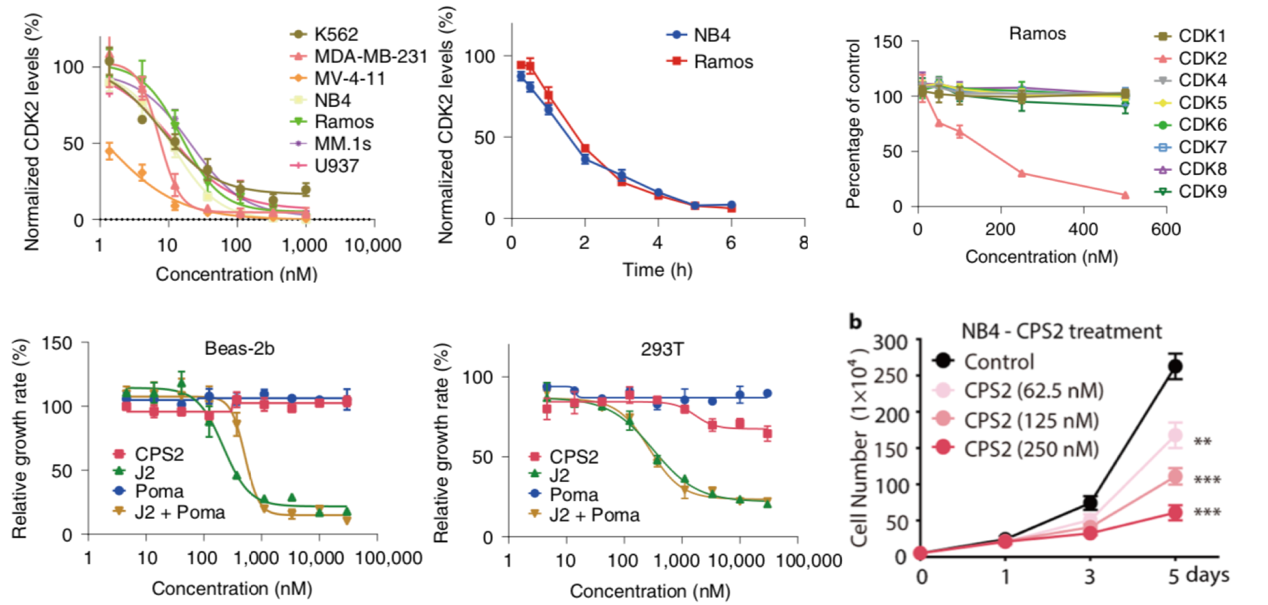 图4 CPS2选择性降解CDK2,阻滞肿瘤细胞增殖(Wang et al., 2021)
图4 CPS2选择性降解CDK2,阻滞肿瘤细胞增殖(Wang et al., 2021)
代表性工作三:首个双机制降解剂GBD-9
目前的蛋白降解疗法主要包括PROTAC与分子胶,PROTAC虽便于设计但分子量大,成药性不足,分子胶虽分子量小,但设计难度大。理论上,如果能够平衡PROTAC与分子胶的优劣之处,将两种技术巧妙融合,将进一步推进蛋白降解技术的发展并实现更好的治疗效果。饶燏教授团队就此首次提出双机制降解剂的蛋白降解疗法,在原BTK降解剂的基础上设计了一个分子库,经过分子动力学模拟开发出了GBD-9。GBD-9可以同时敲降两种蛋白,以PROTAC机制降解BTK、以分子胶形式降解翻译终止因子GSPT1。在多种弥漫性大B细胞淋巴瘤(DLBCL)和急性髓细胞白血病(AML)细胞系的抗增殖实验中,GBD-9显示出比依鲁替尼更强的效果,具有很大的治疗潜力(图5)。
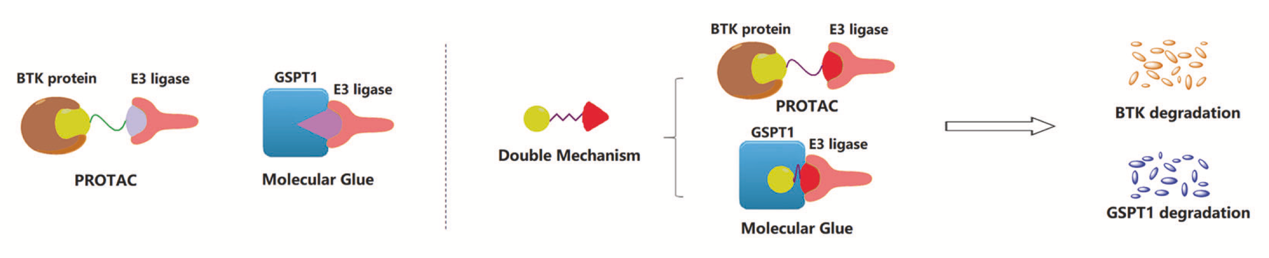
图5 GBD-9双机制降解BTK与GSPT1 (Yang et al., 2021)
最后,饶燏教授认为PROTAC既是一种新药研发技术,同时也是一种新型生物学研究的工具。另外,尽管PROTAC有独特的优势,但仍有许多挑战,例如膜蛋白就不容易被PROTAC方式降解,需要通过LYTAC的方式降解,而且PROTAC在线粒体里也难以实现,可能由于泛素难以进入线粒体。针对这些难以被PROTAC操纵的靶点,亟待开发新的技术。
Q&A
在这次的精彩报告之后,饶燏教授和在场师生进行了热烈的交流。
Q1:为什么PROTAC技术对于BTK蛋白发生突变的容忍度提高,在降解野生型和突变体时效果都比较稳定,并且为什么PROTAC技术会有较高的选择性?
A1:现有BTK共价抑制剂选择性是通过识别并结合BTK激酶口袋附近区域的半胱氨酸来实现的。当共价交联的氨基酸突变后,抑制剂无法再结合而失去抑制活性。PROTAC分子与靶蛋白不需要很强的结合力,就可以实现高效降解,这是一个优势。另外PROTAC分子诱导E3泛素连接酶识别的是激酶的整体,不是某一区域如激酶结合域,所以可以产生很高的选择性。
Q2:可以把PROTAC分子做成共价的形式吗?
A2:可以,但是没有很大必要,因为PROTAC分子本身就是以非共价、催化降解作为优势,能实现multiple turnover的降解效果。
Q3:不同的E3 ligase会对不同PROTAC有影响吗?
A3:可能会有。进一步优化可以发现新的E3 ligase配体,这些不同类型的配体可能会产生不同的蛋白降解效果及相应的生物学效应。
Q4:PROTAC都是利用E3 ligase降解其他蛋白,那么能不能把E3 ligase降解,进而稳定那些因降解而致病的蛋白?
A4:理论是可以的,之前多研究的是降解蛋白的方法,稳定蛋白的研究不多,通过降解E3 ligase去稳定蛋白也是可行的。
参考文献
Li, X., and Song, Y. (2020). Proteolysis-targeting chimera (PROTAC) for targeted protein degradation and cancer therapy. Journal of Hematology & Oncology 13 , 50.
Neklesa, T.K., Winkler, J.D., and Crews, C.M. (2017). Targeted protein degradation by PROTACs. Pharmacology & Therapeutics 174 , 138-144.
Sun, Y., Zhao, X., Ding, N., Gao, H., Wu, Y., Yang, Y., Zhao, M., Hwang, J., Song, Y., Liu, W. , et al. (2018). PROTAC-induced BTK degradation as a novel therapy for mutated BTK C481S induced ibrutinib-resistant B-cell malignancies. Cell Research 28 , 779-781.
Wang, L., Shao, X., Zhong, T., Wu, Y., Xu, A., Sun, X., Gao, H., Liu, Y., Lan, T., Tong, Y. , et al. (2021). Discovery of a first-in-class CDK2 selective degrader for AML differentiation therapy. Nature Chemical Biology 17 , 567-575.
Yang, Z., Sun, Y., Ni, Z., Yang, C., Tong, Y., Liu, Y., Li, H., and Rao, Y. (2021). Merging PROTAC and molecular glue for degrading BTK and GSPT1 proteins concurrently. Cell Research.
报告人: 清华大学 饶燏教授
撰稿人: 程玘轩(汪阳明实验室)
