功能失调的血管内皮细胞 (ECs) 是包括动脉粥样硬化在内多种心血管疾病的病理生理学基础,通过导入外源基因调节血管内皮细胞的功能有望实现对动脉粥样硬化等疾病的治疗。然而,目前仍然缺乏在血管内皮中进行精准调控转基因表达的有效方法。北京大学未来技术学院戴志飞教授团队使用临床诊断用超声和微泡超声造影剂联合腺相关病毒(AAV)载体建立了一种超声影像引导的在体动脉血管内皮细胞转基因递送新策略(UMGAAV),首次以无创的方式实现了动脉内皮细胞转基因表达的空间调控,并且在小鼠模型中实现了对颈动脉斑块的治疗。该研究成果近期以“Spatial control of robust transgene expression in mouse artery endothelium under ultrasound guidance”为题在Signal Transduction and Targeted Therapy杂志在线发表。
为了建立 UMGAAV策略,研究团队使用临床诊断用超声成像系统,其工作频率为 4.4 MHz,该探头也用于临床颈动脉超声成像。在彩色多普勒模式下,可以清楚地看到小鼠的颈动脉,并且可以在图像上选择感兴趣区域,从而使超声可以聚焦在该区域。注射微泡后,可以在成像探头发出的超声作用下将微泡在感兴趣区域选择性爆破,从而提高该区域组织的通透性。之后注射AAV载体可以实现外源基因在该区域的高特异性表达,实验结果显示超声的作用可以使内皮细胞中转基因的表达提高约24倍,并且能维持高表达8周以上。此外,超声的作用还将外源基因在血管内膜和外膜中的表达提高了约86倍,表明UMGAAV也可以用于其它血管细胞(如平滑肌细胞)的转基因靶向递送。
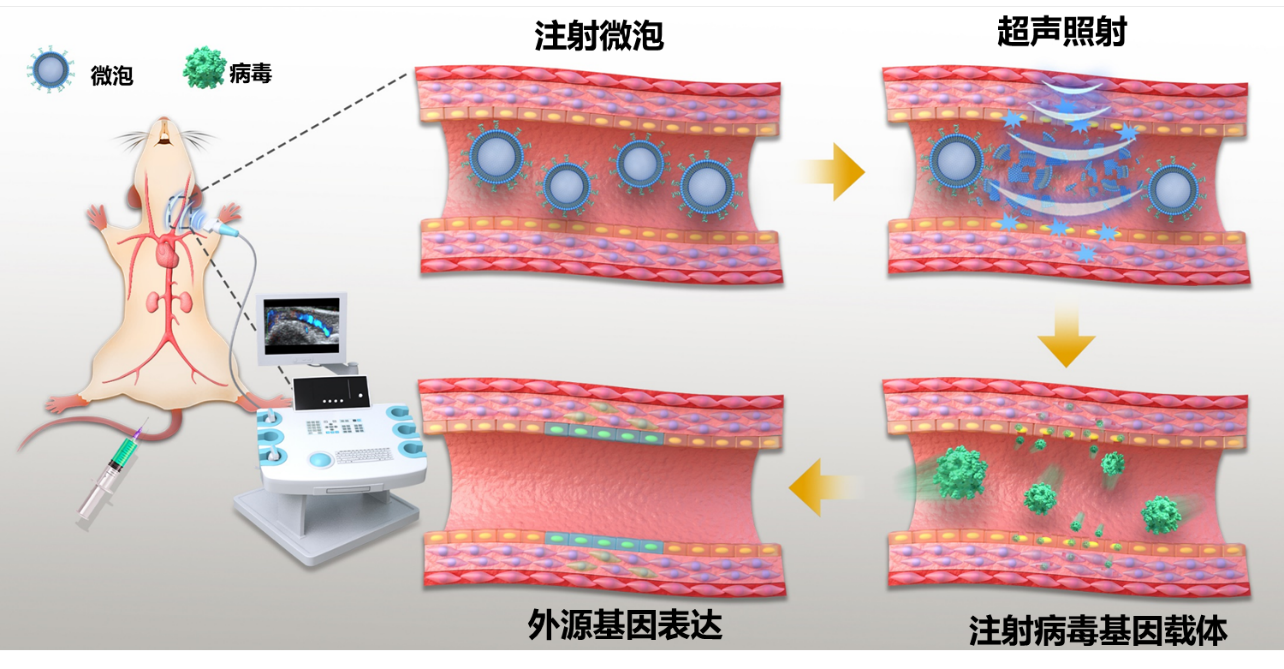
除颈动脉外,理论上来说UMGAAV可用于将外源基因递送至所有可以通过超声成像监测到的血管区域。在这项工作中,该团队在小鼠腹主动脉和股动脉中成功验证了UMGAAV策略的可行性。最后,他们测试了 UMGAAV 在治疗动脉粥样硬化中的应用,在小鼠颈动脉部分结扎动脉粥样硬化模型中,UMGAAV介导的KLK10基因(团队新鉴定的一个动脉粥样硬化抑制基因, eLife 2022, 11, e72579)的靶向递送能够显著抑制小鼠颈动脉斑块的形成。
综上,戴志飞教授团队建立了一种通过超声影像引导实现外源基因在动脉血管内皮特定区域可控表达的新方法。该方法所使用的超声成像仪器已在临床上广泛使用,AAV 基因载体已在多个临床试验中得到验证,微泡超声造影剂为戴志飞教授团队自主研发,已获中国药监局批准,正在开展多中心III期临床试验。因此,UMGAAV 具有很好的临床转化潜力。
该论文的共同第一作者为北大未来技术学院博士后刘仁发和2018级博士生屈帅,北大未来技术学院戴志飞教授为通讯作者,佐治亚理工学院和埃默里大学的Hanjoong Jo教授也为本研究的顺利进行提供了帮助。该研究主要得到国家自然科学基金(No.81930047; No. 82102062)和中国博士后科学基金(2020TQ0008)的支持。
