报告人:清华大学 邵玥副教授 记录人:张晓姗(汪阳明实验室)
2021年10月29日下午,受北京大学未来技术学院分子医学研究所汪阳明教授邀请,清华大学航天航空学院工程力学系邵玥副教授在未来技术学院报告厅带来了一场以“生命孕育的力学调控机理与应用”为主题的精彩报告。
邵玥博士于2016年在美国密歇根大学机械工程系获得博士学位;2017年至2019年作为博士后在麻省理工学院和哈佛医学院进行深入研究,并于2020年在《麻省理工科技评论》中成为TR35获奖者之一。邵玥博士的主要研究成果包括用机械微系统诱导多能干细胞模拟着床期胚胎发育,建立了着床期至原肠胚期的羊膜囊类胚胎模型,发展了“无胚化” 的人类胚胎研究技术。
背景介绍
生命孕育:既古老又现代的科学
早在1510-1512年,达芬奇首次绘制了子宫中的胎儿手稿,便为人类开启胚胎发育这扇大门。随着胚胎发育研究的发展,试管婴儿辅助生殖技术应运而生,并逐渐成为了生殖障碍以及不孕不育人群的福音,该技术也因此获得了2010年诺贝尔奖。由此可见,人类自古以来就一直在探索生命孕育的奥秘,这不仅是人类自我认识的一个过程,同时也能够帮助我们解决生命进程中的诸多问题。
当今社会飞速发展,人类的生活水平以及健康状况也在日益改善,然而我国的第七次人口普查结果却显示,我国少子化问题严重,主要体现在生育率已经普遍低于发达国家水平。因此我国迫切需要改变人口结构,进而缓冲生育率低下所带来一系列社会问题。生殖健康是影响生育率的主要因素,近年来我国的生殖健康的问题也十分凸显,由北医三院牵头的临床数据结果显示我国不孕不育率在25年中几乎翻了一倍,已经达到了15%到25%。由此可见,建立一个既高效又符合伦理的胚胎发育研究评价体系和干预方法是我们深入认识和应对生殖健康的关键基础,这也成为了邵玥博士相关研究的主要出发点。
胚胎着床是胚胎早期发育的重要过程,与生殖水平息息相关。新英格兰医学杂志上的临床研究表明,胚胎着床后发育失败导致没能建立成功妊娠的情形大致占总的临床妊娠丢失数的25%-40%,由此可见着床后的胚胎发育确实是成功建立妊娠的关键,同时暗示着着床后发育失败是导致不孕不育的重要原因之一。然而,胚胎着床之后会发生一系列复杂的变化,而这个过程目前在临床上无法通过任何生化手段进行检测。半个多世纪以来我们对胚胎着床后发育的认识大多来自对早期胚胎切片的研究,随后干细胞的发现为人类胚胎着床后发育研究提供了模型,利用干细胞重构的囊胚,我们能够观察到早期胚胎发育的过程,然而目前这种重构囊胚的系统没有很好的运用到胚胎着床后模型的建立,主要是由于重构囊胚技术和体外培养系统在效率和一致性上都具有一定限制,此外,这种类原肠胚的模型虽然能够模拟三胚层形成的过程,但是胚胎着床后的一系列关键事件,包括羊膜腔形成与分化以及羊膜囊的形成等是缺失的。由此可见,目前以干细胞为基础所建立的体外模型虽然在研究胚胎发育中发挥重要作用,但是还是无法模拟胚胎着床后一系列的发育过程。
如何在体外去模拟胚胎着床后的一系列过程,这也成为邵玥博士团队想要重点攻克的难题。近几年有研究发现在胚胎发育过程中互作力和生命活动有协同作用,比如有研究表明细胞间的张力可以调控小鼠囊胚的发育,主要是影响囊胚中滋养层和内细胞团发育的比例,抑制细胞张力后,内细胞团会变多,滋养层会变少(图1);同时有研究对于体外培养的鼠胚设置了受限空间,通过有限空间挤压与自由发育两种方式的比较,发现在侧向约束的情况下,鼠胚能够正常发育成体轴的结构,分化出一个前后端,而在没有侧向约束的情况下便无法进行体轴发育,说明机械约束影响体轴发育(图2);此外还有研究表明鼠胚着床后发育中原肠胚运动的机械重塑对于分化以及转分化起到重要作用(图3)。这些研究暗示了力学因素以及力学环境对于体外建立胚胎发育的模型可能起到重要的作用,比如羊膜腔的形成等,并且,通过人为添加生化因素协同物理因素达到更加贴近于胚胎发育的真实情况,或许有助于完善胚胎发育体外模型的建立。作为力学出身的邵玥博士利用学科交叉手段,致力于研究细胞或组织之间的作用力、细胞与环境间的力学互作等在生命活动中所起的作用,利用多能干细胞构建了多种新型类胚胎和类器官模型,实现着床期、原肠期、神经胚等阶段的多个发育过程的体外重现,推进生命孕育的力学调控原理的转化应用。
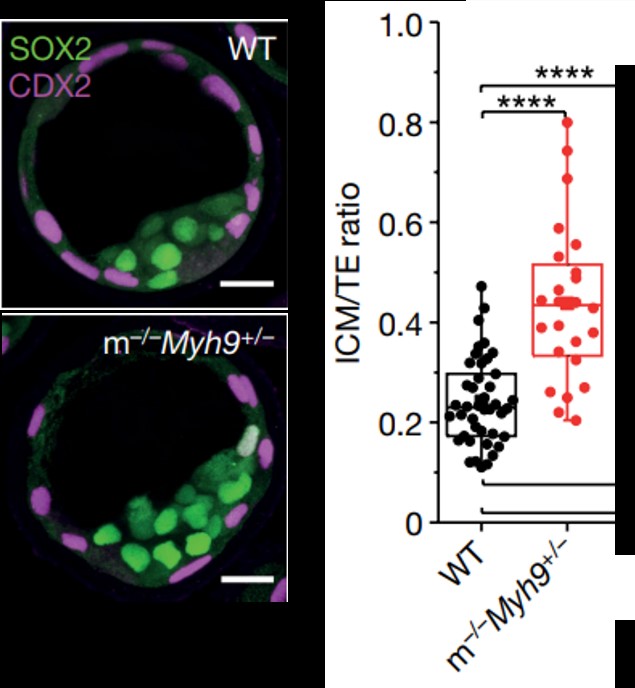
1 细胞张力调控小鼠囊胚发育[1]
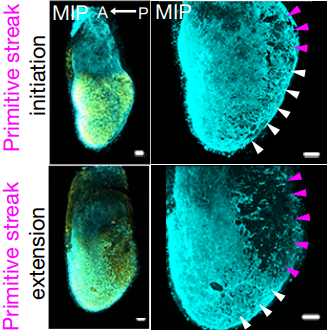
图2 基质机械重塑调节鼠胚着床后发育[2]

图3 机械约束影响鼠胚胎着床后体轴发育[3]
代表性工作
一、胞内“预制”的腔室形成单元——顶面小体的发现
人类多能干细胞的自发腔室形成可模拟羊膜腔发生过程,但在这个模型中,顶端极化是如何出现的仍不清楚。邵玥博士及合作者发现了一个高度组织化的膜结合的顶端腔室,上面镶有微绒毛和初级纤毛,是一个亚细胞结构单元,他们将其命名为 “apicosome”,也称作顶面小体。其呈现顶面极性和胞外环境的特点。重要的是他们证明了羊膜腔形成是一个基于顶面小体结构的力学介导多级自组装过程。
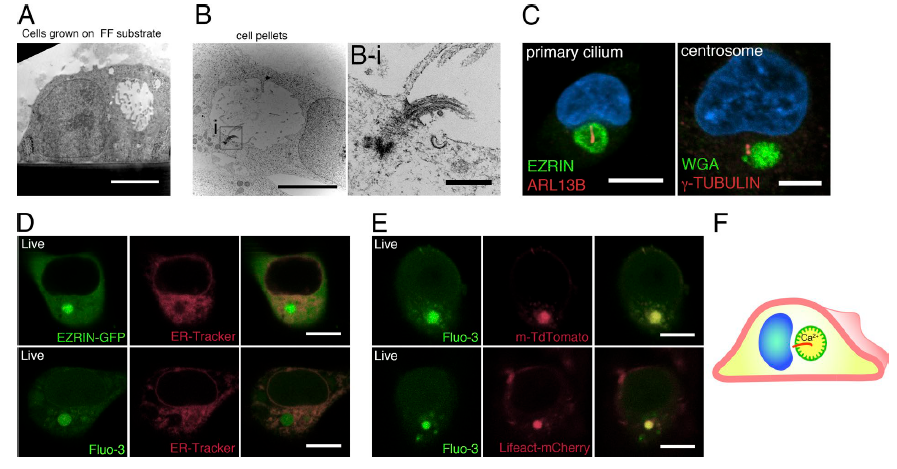
图4 顶面小体呈现顶面极性及胞外环境的特点[4]
二、首次通过调控干细胞力学诱导羊膜分化
羊膜的形成和发育是人类早期胚胎发育和成功怀孕的的一个重要事件。然而着床后羊膜发育过程的物种间差异很大,因此人源模型是十分必要的。邵玥博士发现人多能干细胞在软基质和三维条件培养下,改变了干细胞的力学环境,使其能够形成扁平的鳞状细胞,诱导羊膜分化,在丧失多能性基因的表达的同时高表达羊膜标志物。在三维软环境下,会出现内源BMP蛋白,启动下游的SMAD。 而加入小分子阻断BMP-SMAD通路会抑制干细胞向羊膜上皮分化。这是一种不改变多能干细胞的生化环境,仅靠生物力学因子即可启动羊膜发育的独特方法。

图5 力学环境敏感的羊膜向分化与类羊膜自组装[5]
三、类胚胎揭示BMP-SMAD信号调控羊膜发育与原肠运动的多重作用
不对称的羊膜囊的发育人类胚胎植入过程中的一个重要里程碑。尽管羊膜囊发育对胚胎发育和怀孕至关重要,但对人类的其仍然知之甚少。邵玥博士及团队报告了一个基于人类多能干细胞(hPSCs)的模型,称为植入后的羊膜囊胚胎(PASE),它重现了以羊膜囊发育为中心的多个植入后的胚胎发育事件。在没有母体或胚胎外组织的情况下,PASE自我组织成一个上皮囊,具有不对称的羊膜外胚层-外胚层模式,类似于人类的羊膜囊。在进一步发展后,PASE以SNAI1依赖的方式启动了一个类似于后部原条的发育过程。此外,观察到不对称的BMP-SMAD信号与PASE的发育同时进行,并确定BMP-SMAD的激活/抑制调节稳定的PASE发育。这项研究揭示了人类多能干细胞以前未被认识的命运潜力,并为推进人类胚胎学提供了一个平台。
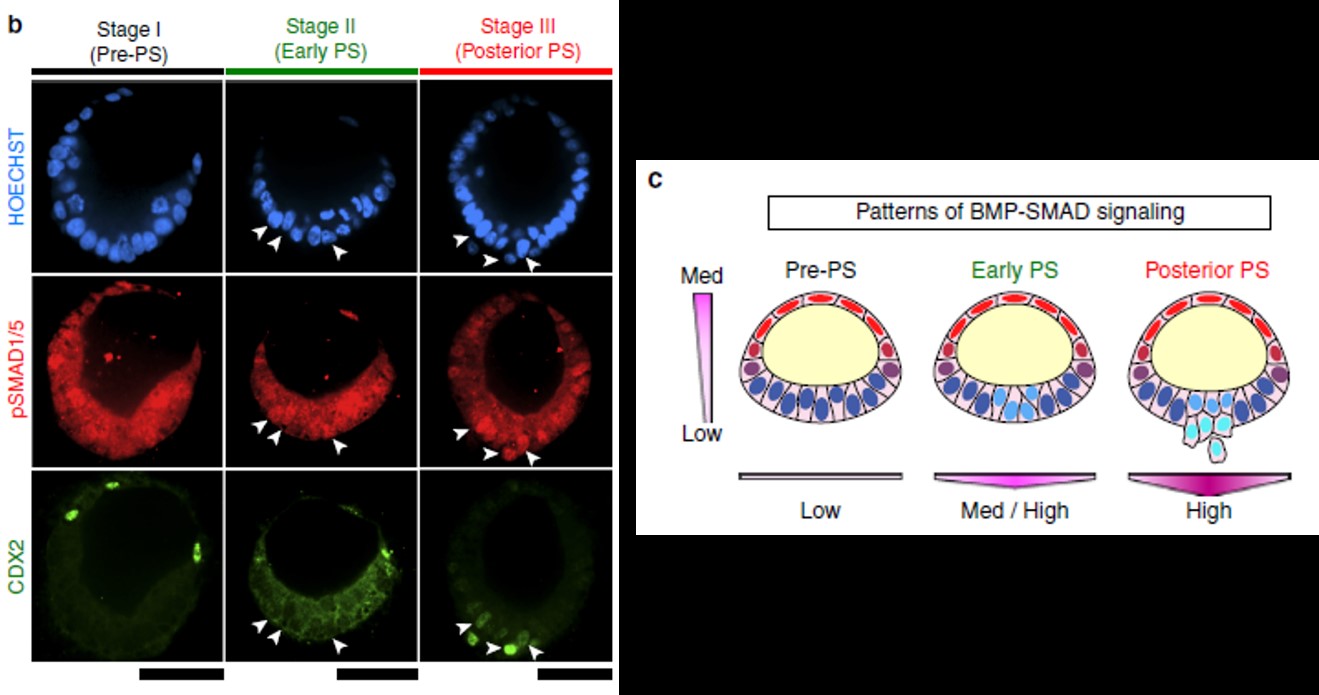
图6 类胚胎揭示BMP-SMAD信号调控羊膜发育与原肠运动的多重作用[6]
四、基于微流控的羊膜囊类胚胎芯片模拟着床后发育
人类早期的胚胎发育涉及到广泛的谱系多样化、细胞命运规范和组织模式化。尽管具有临床重要性,但由于物种间的差异性和人类胚胎样本的可及性有限,人类早期胚胎发育仍相对未得到解释。邵玥博士及其合作者通过微流控装置操控人类多能干细胞(hPSCs),以高度可控和可扩展的方式再现了胚胎发育期上胚层和羊膜外胚层部分的发育标志,包括上胚层的腔隙发育和由此产生的羊膜腔和双极胚囊的形成。他们进一步发现,羊膜外皮细胞作为一个信号中心,在hPSCs中触发了类似原肠胚事件的发生。鉴于其可控性和可扩展性,微流控模型为推进人类胚胎学和生殖知识提供了一个强大的实验系统。这个模型可以帮助合理设计hPSCs的分化方案,用于疾病建模和细胞治疗,以及用于高通量药物和毒性筛选,以防止妊娠失败和出生缺陷。
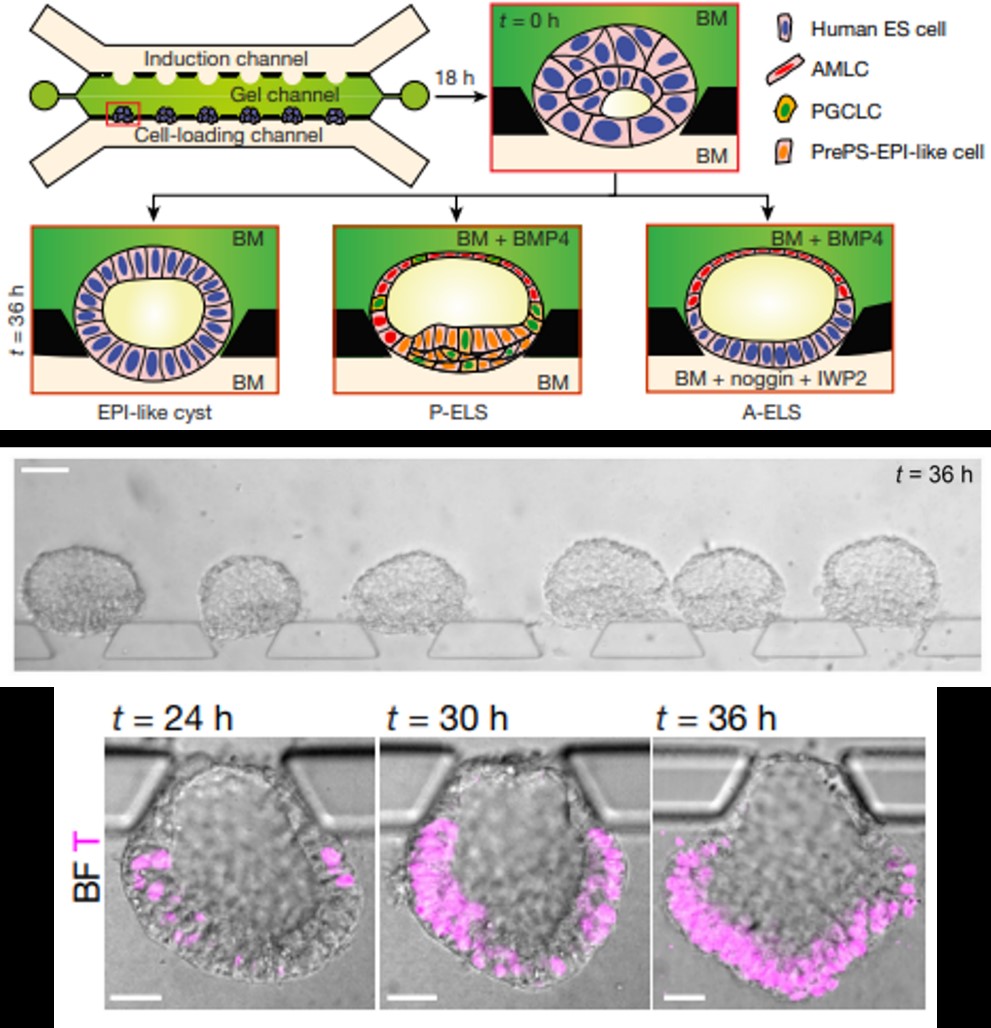
图7 基于微流控的羊膜囊类胚胎芯片模拟着床后发育[7]
五、基于微阵列的早期胚胎组织毒理筛选方法
在人类胚胎植入后的早期,囊胚内的外胚层(EPI)极化,产生一个具有中央腔的cyst。EPI囊肿的子宫极的细胞随后发生分化,形成羊膜外胚层(AM),这是一个对进一步胚胎发育至关重要的组织。虽然早期妊娠失败的原因很复杂,但EPI的腔体发育或羊膜发育不当是可能的诱因。邵博士报告了一种新型羊膜外胚层 (AM)微组织阵列平台,该平台允许对囊胚内的外胚层(EPI)的腔发生和羊膜发生进行定量表型分析,并证明其在胚胎毒性分析中的潜在应用。具体来说,基于人类多能干细胞 (hPSCs) 的羊膜分化方案是使用两步微图案技术开发的,以生成具有定义组织大小的常规 AM 微组织阵列。开发了一种计算机辅助分析管道来自动处理成像数据并量化 AM 微组织的形态学和生物学特征。对细胞密度、腔体大小和培养条件的影响分析揭示了腔体大小与 hPSCs 的羊膜生成之间存在明显的联系。AM 微组织阵列进一步应用于筛选一组临床相关药物,成功检测到它们的致畸性。这项工作为临床相关药物的毒理学筛选提供了一个技术平台,以了解它们在早期人类胚胎着床期发育过程中对管腔发生和羊膜发生的影响,而这些过程以前是无法进行研究的。
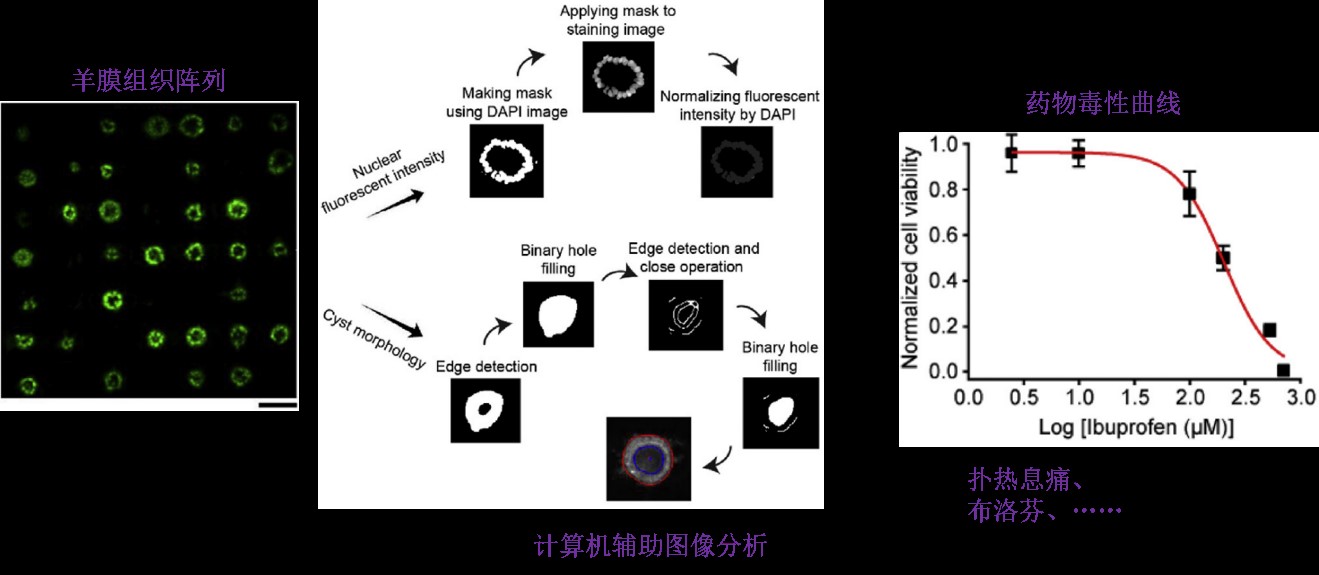
图8 基于体外羊膜阵列的药物胚胎发育毒性筛查技术[8]
六、几何限域边界诱导hPSC产生类神经图样分化
经典的胚胎学研究已经成功地应用遗传学和细胞生物学原理来理解胚胎发育。然而,作为发育的一个整体驱动因素力学如何参与控制组织尺度的细胞命运模式,仍然没有得到解决。邵玥博士与合作者建立了一种基于微图案化人类多能干细胞(hPSCs)的神经外胚层发育模型,其中预图案化的几何限制诱导神经上皮和神经板边界细胞的突现模式,在体内早期神经形成过程中模拟神经外胚层区域化。在这个基于hPSCs的神经外胚层模式化模型中,两种组织尺度的形态发生信号——细胞形状和细胞骨架收缩力——通过 BMP-SMAD 信号传导指示神经上皮/神经板边界模式化。他们进一步表明异位机械激活和外源性 BMP 信号调制足以扰乱神经上皮/神经板边界模式。这项研究提供了一个基于 hPSCs的微工程模型,能够用来理解指导神经外胚层模式形成的生物力学原理,可以用于研究神经发育和相关疾病。
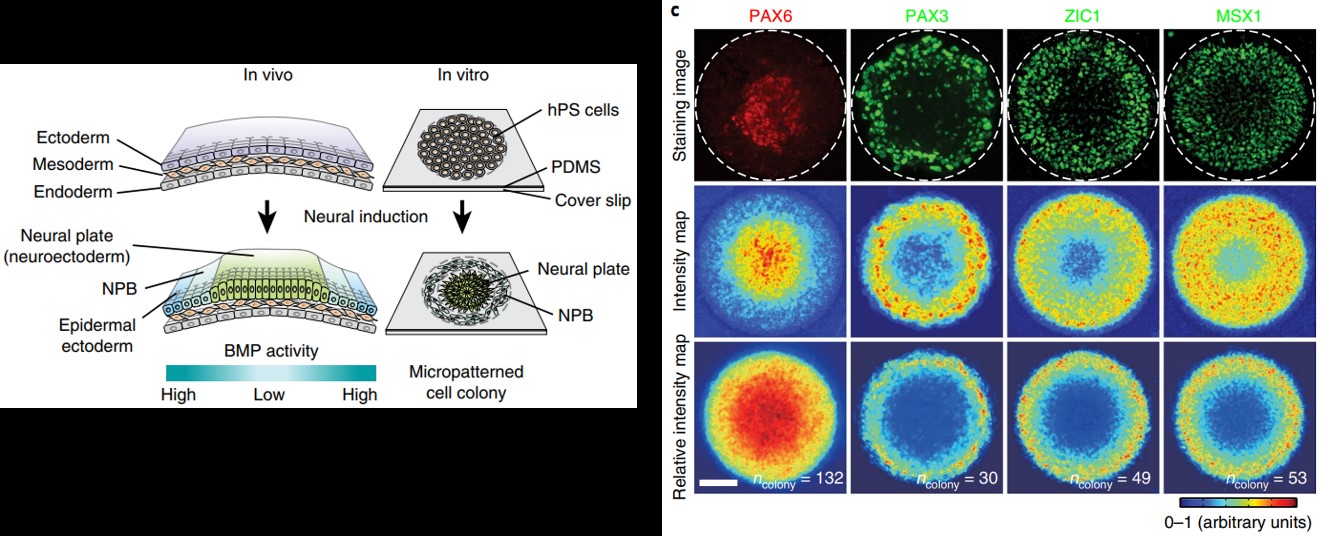
图9 几何限域边界诱导hPSC产生类神经图样分化[9]
问与答:
在邵玥博士的精彩报告之后,他还和在场师生进行了热烈的交流。
问题一:如果在芯片上用siRNA和crispr cas9技术进行基因操作的话,效率如何?这个系统能够将一个小鼠的囊胚养到什么时候?
答:在芯片上直接进行基因操作的实验尚未进行过,可能的限制因素之一是基因操作系统的递送效率。其实像这样的系统并不适合养囊胚,因为微流控系统空间是受限的,不适合持续培养胚胎。如果不限于微流控系统的话,我认为体外培养到e8.5(心脏开始搏动)应该是可以实现的。
问题二:在类器官培养或心脏早期自组装时中如何引入力学因素?
答:工程学上的手段非常多,从亚细胞尺度到组织尺度,流动的或固体的,静态或动态的。具体采用什么方法需要根据场景,需求去决定。
问题三:这些力学信号可以量化出来吗?
答:研究力学环境可以用如原子力显微镜等技术,但对细胞内部受力的量化是一个比较难的事情,目前所用的一些分子探针有一定的局限性。
问题四:有没有考虑过用一些数学的语言去描述胚胎发育的过程,使得我们可以得到想要的胚胎形状或功能?
答:这是一件非常值得做的事,也可能是最终的目标。但目前生命体系当中有许多事情我们不清楚,所以现在时机还不成熟。
问题五:在构建体外模型时,如何验证和体内的一致性?
答:可以利用生物信息学的方法在单细胞层面给体外的模型进行分子“画像”,并与体内情形比对,验证它们的一致性;还可以检测体外模型所得到的细胞是否具有了体内相应情形下应有的一些功能。
参考文献
[1] C.J. Chan, M. Costanzo, T. Ruiz-Herrero, G. Mönke, R.J. Petrie, M. Bergert, A. Diz-Muñoz, L. Mahadevan, T. Hiiragi, Hydraulic control of mammalian embryo size and cell fate, Nature 571(7763) (2019) 112-116.
[2] C. Kyprianou, N. Christodoulou, R.S. Hamilton, W. Nahaboo, D.S. Boomgaard, G. Amadei, I. Migeotte, M. Zernicka-Goetz, Basement membrane remodelling regulates mouse embryogenesis, Nature 582(7811) (2020) 253-258.
[3] R. Hiramatsu, T. Matsuoka, C. Kimura-Yoshida, S.W. Han, K. Mochida, T. Adachi, S. Takayama, I. Matsuo, External mechanical cues trigger the establishment of the anterior-posterior axis in early mouse embryos, Dev Cell 27(2) (2013) 131-144.
[4] K. Taniguchi, Y. Shao, R.F. Townshend, C.L. Cortez, C.E. Harris, S. Meshinchi, S. Kalantry, J. Fu, K.S. O'Shea, D.L. Gumucio, An apicosome initiates self-organizing morphogenesis of human pluripotent stem cells, J Cell Biol 216(12) (2017) 3981-3990.
[5] Y. Shao, K. Taniguchi, K. Gurdziel, R.F. Townshend, X. Xue, K.M.A. Yong, J. Sang, J.R. Spence, D.L. Gumucio, J. Fu, Self-organized amniogenesis by human pluripotent stem cells in a biomimetic implantation-like niche, Nat Mater 16(4) (2017) 419-425.
[6] Y. Shao, K. Taniguchi, R.F. Townshend, T. Miki, D.L. Gumucio, J. Fu, A pluripotent stem cell-based model for post-implantation human amniotic sac development, Nat Commun 8(1) (2017) 208.
[7] Y. Zheng, X. Xue, Y. Shao, S. Wang, S.N. Esfahani, Z. Li, J.M. Muncie, J.N. Lakins, V.M. Weaver, D.L. Gumucio, J. Fu, Controlled modelling of human epiblast and amnion development using stem cells, Nature 573(7774) (2019) 421-425.
[8] S. Nasr Esfahani, Y. Shao, A.M. Resto Irizarry, Z. Li, X. Xue, D.L. Gumucio, J. Fu, Microengineered human amniotic ectoderm tissue array for high-content developmental phenotyping, Biomaterials 216 (2019) 119244.
[9] X. Xue, Y. Sun, A.M. Resto-Irizarry, Y. Yuan, K.M. Aw Yong, Y. Zheng, S. Weng, Y. Shao, Y. Chai, L. Studer, J. Fu, Mechanics-guided embryonic patterning of neuroectoderm tissue from human pluripotent stem cells, Nat Mater 17(7) (2018) 633-641.
