近日,北京大学未来技术学院陈匡时课题组在Nucleic Acids Research上发表题为“Spuriously transcribed RNAs from CRISPR-sgRNA expression plasmids scaffold biomolecular condensate formation and hamper accurate genomic imaging”的研究论文,利用荧光显微成像的手段发现质粒产生的隐转录本(cryptic transcript)会形成具有液滴性质的胞核无膜颗粒,这一现象会导致使用质粒表达基于荧光标记sgRNA的CRISPR基因组成像体系时产生假阳性信号;通过使用sgRNA转录单元——启动子-基因组片段(promoter-gene cassette)可以显著降低假阳性信号的形成,从而实现更准确的活细胞成像。文章链接:https://academic.oup.com/nar/article/53/6/gkaf192/8090309。
质粒转染是一种常用的将目标基因导入细胞的方法。然而,研究发现,很多质粒会发生非特异性的转录活动,产生目标RNA以外的非预期转录产物——隐转录本(cryptic transcript)。该研究首次使用荧光显微成像的方式对质粒产生的隐转录本的亚细胞定位及其性质进行了探究,发现这些隐转录本会与核旁斑(paraspeckle)核心蛋白(如FUS、PSPC1等)相互作用,但不与质粒或NEAT1_2(核旁斑的主要RNA组分)结合,在细胞核中聚集形成具有液滴性质的无膜颗粒。
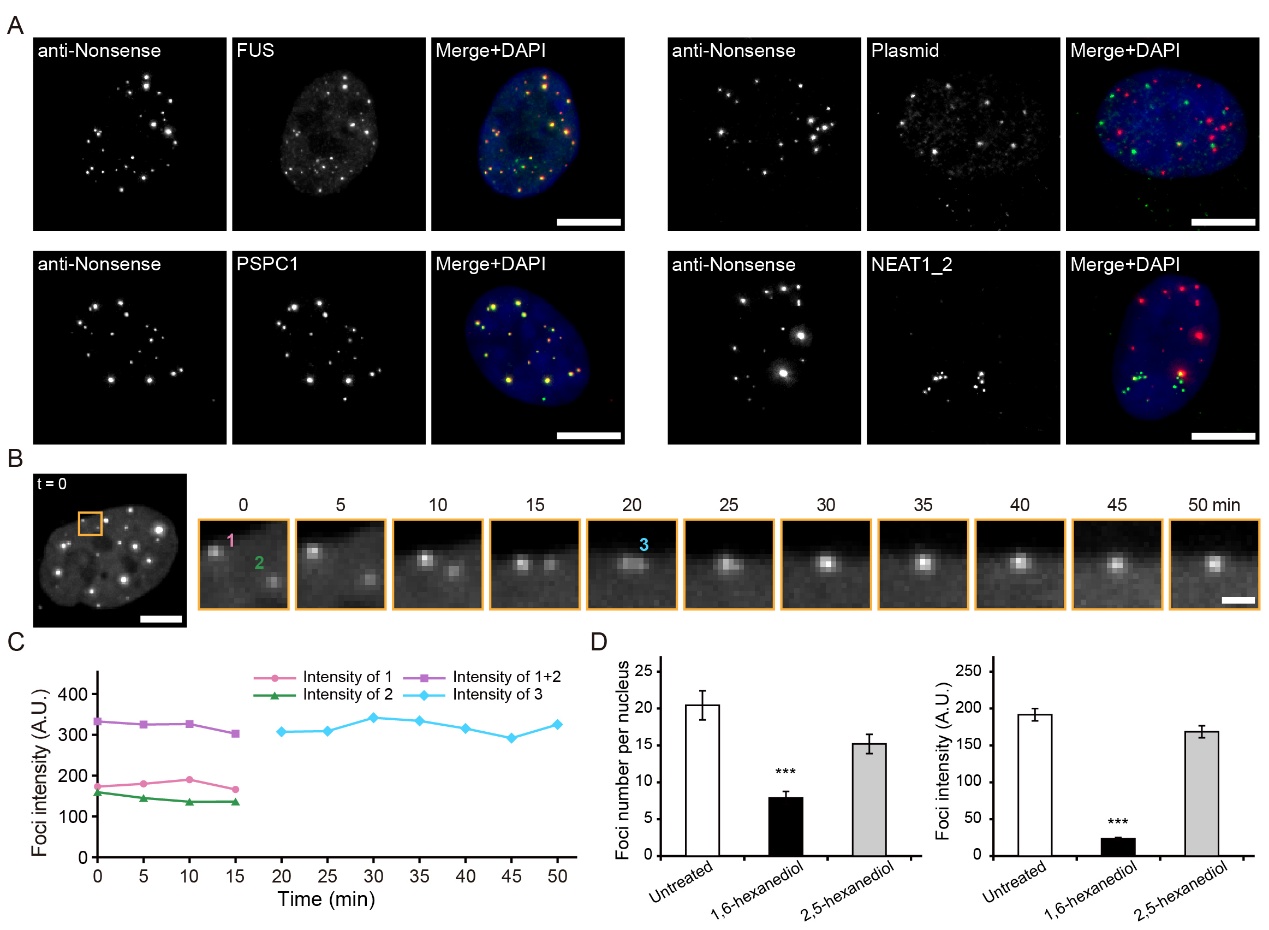
图1. 质粒产生的隐转录本会与核旁斑核心蛋白相互作用,而不与质粒或NEAT1_2相互作用,在细胞核中聚集形成具有液滴性质的无膜颗粒。
因此,在使用质粒表达基于荧光标记sgRNA的CRISPR基因组成像体系(如CRISPR/-MS2/PP7)时,质粒产生的隐转录本可带有可被荧光标记的RNA组分(如MS2/PP7 适配体序列),从而被荧光探针结合,产生假阳性信号。该研究发现,通过PCR或者质粒酶切(restriction enzyme digestion)去除质粒骨架获得的sgRNA转录单元(启动子-基因组片段,promoter-gene cassette)能够在不干扰特异性标记的同时显著降低非特异假阳性信号的形成,在CRISPR-MS2/PP7 和CRISPR/molecular beacon(CRISPR/MB)这两种截然不同的成像体系中均能够实现更准确的基因组成像。
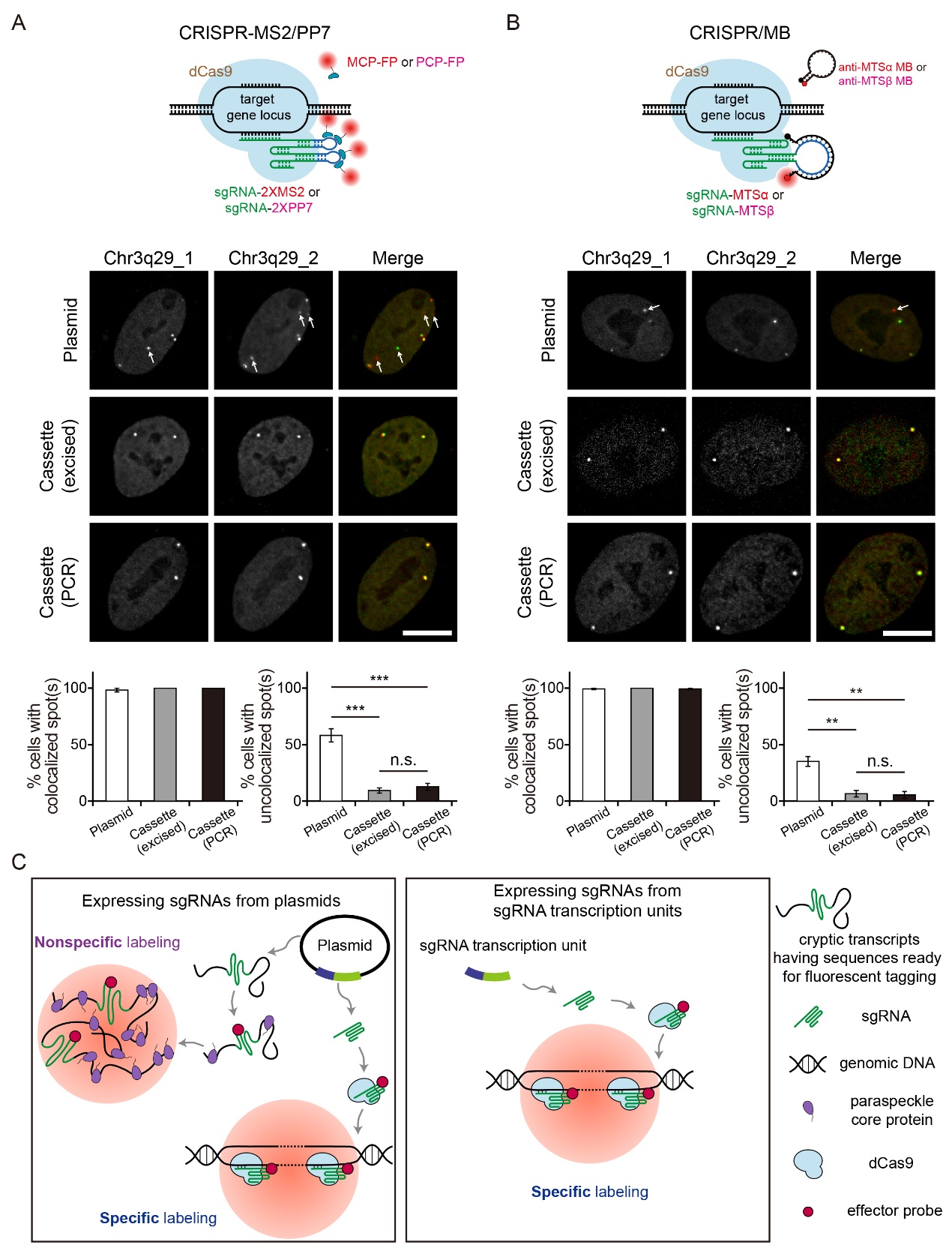
图2. 在CRISPR-MS2/PP7 和CRISPR/MB两种成像体系中,通过PCR或者质粒酶切获得的sgRNA转录单元(PCR-derived/excised cassette)能够在不干扰特异性标记的同时显著降低非特异假阳性信号的形成。
这项研究揭示了先前从未报道的质粒隐转录本性质及其对CRISPR成像准确性的影响,并提出了一个易于实现的解决方案。由于质粒隐转录可在任意质粒上发生,该研究对其它基于报告基因的转录调控研究具有重要意义;该研究发现的隐转录本招募核旁斑蛋白形成不含NEAT1_2的胞核无膜颗粒也对核旁斑等无膜细胞结构的研究具有重要意义。
北京大学未来技术学院陈匡时课题组已毕业博士生毛诗琦、20级博士研究生吴若楠为该论文的共同第一作者。课题组其它成员骆纬邦和秦金珊也为课题完成做出重要贡献。陈匡时研究员为本文的通讯作者。本工作得到了国家重点研发计划和国家自然科学基金的支持。
